 |
BMe Kutatói pályázat |

|
Pattantyús-Ábrahám Géza Gépészeti Tudományok Doktori Iskola
BME GPK, Polimertechnika Tanszék
Témavezető: Dr. Nagy Péter és Dr. Oláh László
Lebomló polimeralapú támasztószövet-regenerációs implantátumanyagok fejlesztése
A kutatási téma néhány soros bemutatása
PhD munkám során olyan implantátum-anyagokkal
foglalkoztam, melyek a sérült szövetrészek helyettesítése helyett, azok
regenerációjának elősegítését tűzik ki célul. Az emberi szervezetbe ültetést
követően az alkalmazott vázanyagok ideiglenesen átveszik a támasztószövet fő
funkcióját – teherviselés – elősegítik a sejtek megtapadását, szaporodását, majd
fokozatosan, lehetőleg a szövet újjáépülésével párhuzamosan, lebomlanak, és
anyagcsere-folyamatok útján kiürülnek a testből.
A kutatóhely rövid bemutatása
Munkámat a BME Gépészmérnöki Karának Polimertechnika Tanszéken végeztem. A tanszéken nagy hangsúlyt fektetnek a minőségi működésre. Ennek eredménye, hogy 2002-ben a felsőoktatási tanszékek közül az országban elsőként ISO 9001 Minőségirányítási Rendszert vezettek be, majd 2004-ben a NAT a tanszéki vizsgálólaboratóriumot is akkreditálta. A tudományos tevékenység színvonalát jól jelzi a publikációk száma és minősége, valamint a tanszék gondozásában havonta megjelenő, impakt faktorral is rendelkező angol nyelvű folyóirat, az eXPRESS Polymer Letters.
A kutatás történetének, tágabb kontextusának bemutatása
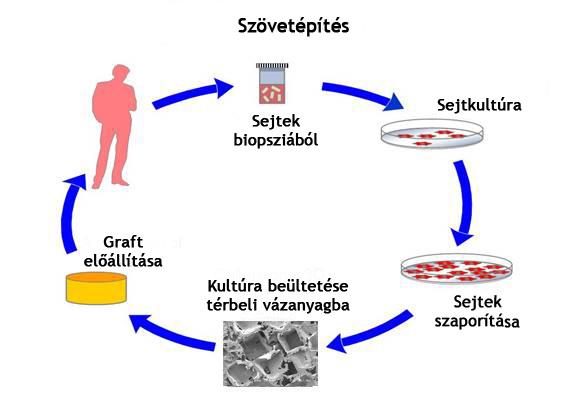 A szövetépítés (lásd
séma jobbra), a szövetek fő funkcióinak helyreállítása élő sejteket tartalmazó
implantátumokkal nem teljesen új elgondolás; már az 1980-as évek elején is
folytak kísérletek e területen. Sőt az akkoriban kifejlesztett bőrregenerációs
technikákat ma már klinikailag is alkalmazzák.
A szövetépítés (lásd
séma jobbra), a szövetek fő funkcióinak helyreállítása élő sejteket tartalmazó
implantátumokkal nem teljesen új elgondolás; már az 1980-as évek elején is
folytak kísérletek e területen. Sőt az akkoriban kifejlesztett bőrregenerációs
technikákat ma már klinikailag is alkalmazzák.
Jelentős változást az 1990-es évek hoztak, amikor megkezdődött a térbeli, nagy kiterjedésű vázanyagok fejlesztése [1]. Az azóta eltelt időben jelentős előrelépések történtek a vázanyagok gyártástechnológiáit, a felhasználható anyagokat és az élő sejtek beültethetőségét illetően. Minden igényt kielégítő megoldás azonban még nem látott napvilágot.
Az implantátum fő feladata az elhalt szövet funkciójának ideiglenes helyettesítése, illetve a regeneráció elősegítése. Az előbbit támasztószövet-implantátumok esetében megfelelő mechanikai szilárdsággal és merevséggel lehet elérni, míg utóbbit különböző biológiailag aktív anyagok felhasználásával („bioaktív” kerámiák, növekedési faktorok, esetleg őssejtek). Az alapanyagok kiválasztása során a legfontosabb szempont a beültetett vázanyag biokompatibilitása, azaz a szervezettel való összeférhetősége. Mivel felszívódó polimerek és kerámiák kerülnek felhasználásra, ezért a beültetett vázanyagok bomlástermékei sem lehetnek mérgezők, és nem válthatnak ki krónikus gyulladásos reakciókat.
Az eddigi in vivo
és klinikai tapasztalatok alapján fény derült arra is, hogy az alkalmazott
polimer alapanyagokkal kapcsolatos fő probléma a szövet környezetében
bekövetkező pH-csökkenés, illetve az implantátum széttördelődése, betokozódása.
Ez utóbbi akár a műtét után 5–7 évvel is problémát jelenthet. A csont átépülése
során ugyanis az apró szemcsék ismételten gyulladásokat okozhatnak [2].
A gyártástechnológiák fejlesztése során külön hangsúlyt fektettek azokra a megoldásokra, amelyek lehetőséget adnak egyedi vagy kisszériás termékek gyártására. Így kerültek előtérbe az úgynevezett gyors prototípus-gyártási technológiák. Előnyük, hogy segítségükkel egy lépésben – például egy CT (számítógépes tomográfia) felvétel alapján készített 3D CAD modellből – anyaghozzáadással közel tetszőleges geometria előállítható. A termék ebben az esetben lehet az implantátum vagy az implantátum alapját képező szerszám is [3].
A kutatás célja, a megválaszolandó kérdések
Kutatásom elsődleges célja olyan implantátum-anyagok előállítása, amelyek megfelelő mechanikai tulajdonságokkal rendelkeznek ahhoz, hogy hosszabb ideig (kb. 3–6 hónap) helyettesítsék a porózus csontállományt. Mivel a csontszövet regenerációja során az implantátum fokozatosan elveszíti teherviselő képességét, ezért in vitro körülmények között, háromdimenziós vázanyagokon vizsgáltam a bomlás sebességét. A mechanikai jellemzők közül külön hangsúlyt fektettem a törésmechanikai tulajdonságokra. A jelentősebb szívósság elérése ugyanis megakadályozhatja az implantátum széttördelődését, mellyel elkerülhetők az utólagos gyulladásos reakciók. Munkám során kitértem az általam alkalmazott anyagokból készült egyedi implantátumok gyártására, valamint a biokompatibilitási vizsgálatokra is.
Módszerek
Felhasznált anyagok
Vizsgálataim során biokompatibilis polimereket (polikaprolakton, polilaktid, lizin-izocianát), valamint sókat (kalcium-karbonát, trikalcium-foszfát) használtam fel.

Vázanyagok előállítása
Az összetevők ömledékes keverését követően a vázanyagokat (lásd ábra jobbra) préseléssel állítottam elő. A porózus szerkezetek előállításához részecskekioldásos technikát alkalmaztam. Pórusképző anyagként konyhasót használtam, mely az alakadást követően vízzel könnyen kioldható, és segítségével 70% sótartalom felett összefüggő, nyílt cellás habszerkezet állítható elő [4]. Az így kialakított struktúra lehetővé teszi a sejtek implantátumba való benövését, és a gyártás során elkerülhető a mérgező anyagok használata.
Mechanikai vizsgálatok
Az alapanyagok mechanikai tulajdonságainak jellemzésére a kvázistatikus nyomó-, illetve húzóvizsgálatokon túlmenően törésmechanikai méréseket is végeztem. Mivel az általam használt polimerek képlékenyen viselkednek az adott vizsgálati körülmények mellett, így a hagyományos lineárisan rugalmas törésmechanikai elvek nem alkalmazhatók. A szívósság jellemzésére az úgynevezett lényegi törésmunka módszert használtam, melynek lényege, hogy a törési munkát két részre bontja. Az egyik rész az új töretfelületek kialakításához szükséges lényegi törésmunka, míg a másik a képlékeny zóna térfogatában disszipált energiával arányos mennyiség, a képlékeny törésmunka [5].
Egyedi implantátumok előállítása
Mivel az orvostechnikában minden eset más és más, ezért a gyorsan és olcsón rendelkezésre álló egyedi implantátumoknak külön jelentősége van. Ilyen termékek előállítására egy olyan módszer került kifejlesztésre, melynek segítségével CT felvételek alapján, gyors szerszámozással (Rapid Tooling, RT), majd ezt követően préseléssel rövid időn belül (tömör implantátumok esetében 1–2 nap, porózus implantátumoknál pár hét) beültethető implantátumok állíthatók elő. A szerszámok gyártása során vizsgáltunk 3D nyomtatott, illetve az ún. Objet technikával előállított mintákat is. Az alkalmazott módszerek előnyei: gyorsaság, csíramentes környezetben történő gyártás, valamint a fémszerszámokhoz képest jelentősen alacsonyabb ár.
Degradációs és biokompatibilitási vizsgálatok
Az általam használt polimerek, illetve a belőlük készült vázanyagok bomlási vizsgálatait in vitro körülmények között – 37°C-on, testfolyadék-szimulációs oldatban – végeztem el. A hidrolitikus degradáció hatásait két éven keresztül figyeltem meg. Nyomon követtem az anyagszerkezeti változásokat, a pufferoldat pH ingadozását, valamint a mechanikai jellemzők változásait. A biokompatibilitási vizsgálatok közül a sejtmegtapadási és szaporodási vizsgálatokat a Semmelweis Egyetem I. sz. Patológiai és Kísérleti Rákkutató Intézetével együttműködésben végeztem. A sejtek porózus vázanyagokba történő benövésének vizsgálatát az Országos Vérellátó Szolgálat Kísérletes Génterápiás Laboratóriumában végzik.
Eddigi eredmények
Az elért eredményeim közül elsőként kitérek a polilaktid/polikaprolakton keverékek összeférhetőségének javítására. Ezt követően ismertetem a bioaktív sókkal töltött rendszerekkel elért eredményeimet. Végül bemutatom az implantátumok gyors szerszámozással történő gyártásának módszerét, valamint az eddigi in vitro degradációs és biokompatibilitási vizsgálatokat.
Biokompatibilis polimer keverékek
 A polimer keverékek
előállítása során a polikaprolakton szívósságát kívántam ötvözni a polilaktid
nagyobb szilárdságával, modulusával. Mivel e két polimer nem elegyedik, ezért
keverékeik nem rendelkeznek a kívánt jellemzőkkel. A kialakult diszperz,
eloszlatott morfológia alkotói közti gyenge határfelületi kapcsolat
eredményeként a tönkremenetel többnyire a gyenge határrétegeken keresztül halad
(lásd ábra balra).
A polimer keverékek
előállítása során a polikaprolakton szívósságát kívántam ötvözni a polilaktid
nagyobb szilárdságával, modulusával. Mivel e két polimer nem elegyedik, ezért
keverékeik nem rendelkeznek a kívánt jellemzőkkel. A kialakult diszperz,
eloszlatott morfológia alkotói közti gyenge határfelületi kapcsolat
eredményeként a tönkremenetel többnyire a gyenge határrétegeken keresztül halad
(lásd ábra balra).
A két fázis összeférhetőségének javítása érdekében reaktív kompatibilizálószereket, lizin-izocianátokat adtam a rendszerhez. A reaktív anyag kis mennyisége (0,5 súlyrész) ellenére jelentős javulást sikerült elérni a keverékekben. A határfelületi feszültség csökkent, finomabban eloszlatott szerkezet alakult ki. A mechanikai eredmények közül kiemelkedik a lényegi törésmunka értékek javulása, mely egyes keverékekben több, mint kétszeres volt a kompatibilizálatlan referenciaanyaghoz viszonyítva.
Bioaktív kompozitok 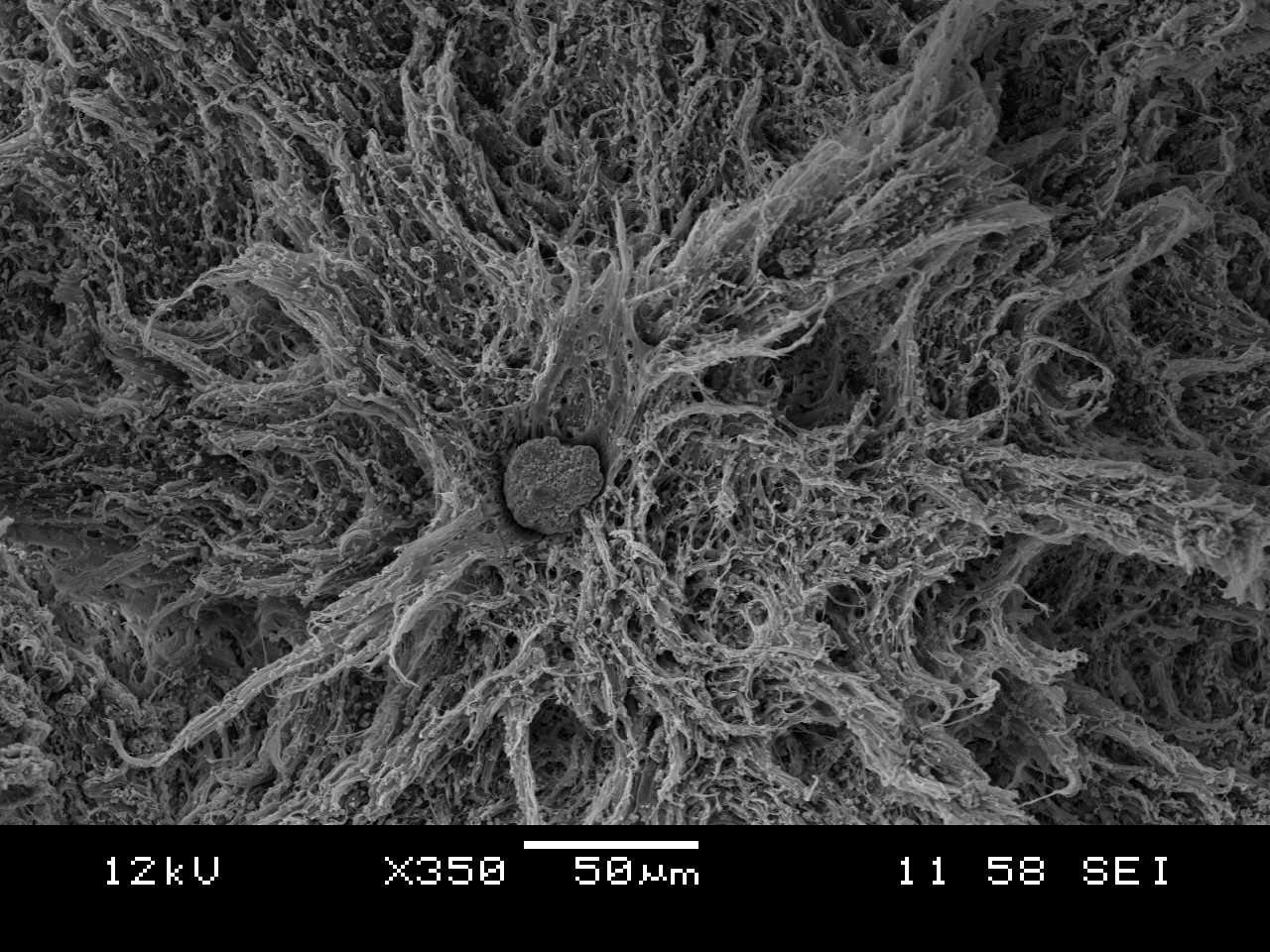
Előállítottam polikaprolakton, illetve polikaprolakton/polilaktid mátrixú kalcium-karbonát és β-trikalcium-foszfát erősítésű kompozitokat is. A cél ezeknél az anyagoknál a szívósság megőrzése mellett a mechanikai szilárdság és a biokompatibilitás javítása volt. Vizsgáltam a töltőanyag alakjának (kalcium karbonát esetében: gömbszerű kalcit, illetve tűs aragonit) és mennyiségének hatását is. Összességében elmondható, hogy mindegyik só alkalmas a mechanikai teherbírás növelésére. Segítségükkel sikerült elérni a porózus csontállomány szilárdságát is. Egy bizonyos töltőanyag-tartalom felett azonban a kialakult aggregátumok (lásd ábra jobbra) jelentősen rontják a szívósságot, ami határt szab az erősítőanyagok alkalmazhatóságának.
Egyedi implantátum gyártása gyors szerszámozással
Az előállított alapanyagokból, egyedi szerszámokban, többszörösen görbült felületű implantátumok préselését is sikerült megvalósítani. Az itt használt gyors-szerszámozásos technológia alapja egy CT felvételből készült 3D CAD fájl volt. Ez alapján készült el a szerszám modellje, majd 3D nyomtatóval, illetve Objet eljárással egyaránt gyártásra került az alakadó eszköz. (1. ábra) Mindkét típus megfelelt polikaprolakton alapú minták préseléséhez, azonban az utóbbi gyártástechnológia esetén a kisebb érdesség miatt könnyebb volt a szerszámnyitás, az implantátum eltávolítása. A préselést követően a porózus vázanyagok előállításához, a felhasznált só eltávolításához, további 2–3 hét vízben történő áztatás szükséges.



1. ábra 3D nyomtatással és Objet technológiával készült présszerszámok, illetve az elkészült implantátum
In vitro degradációs vizsgálatok
Szimulált testfolyadékban végzett vizsgálataim alátámasztották azt a feltételezést, miszerint részben kristályos polimerekben – esetemben polikaprolakton – az amorf fázis bomlása gyorsabb, mint a kristályos részeké. Ezt a kristályosság növekedésével sikerül kimutatni, és a két fázis eltérő diffúziós jellemzőivel magyarázható. A láncok tördelődésének, az átlagos molekulatömeg csökkenésének további következménye a nyomószilárdság romlása, és a vizsgált minták rideggé válása. Megfigyelhető volt a tömör, illetve porózus minták bomlási sebességének eltérése is, ami szintén a különböző anyagvastagságokból eredő eltérő diffúziós tulajdonságokkal hozható összefüggésbe.
Biokompatibilitási vizsgálatok
Sejtszámlálásos vizsgálatokkal sikerült kimutatni, hogy a minták felületén megtapadt és szaporodott sejtek száma jelentősen növelhető kalcium-karbonát sók polimerhez adásával. Ezek az anyagok fokozzák az implantátumok bioaktivitását, és a bomlás során a környező szövet pH változásait is stabilizálhatják.
A porózus vázanyagokon végzett kutatások alátámasztották, hogy az előállított nyílt cellás habok pórusmérete elegendő a sejtek benövéséhez (2. ábra). A térbeli kiterjedésű sejtes szerkezet előállítását egyelőre a felszíntől távolabbi rétegek tápanyagellátása hátráltatja.
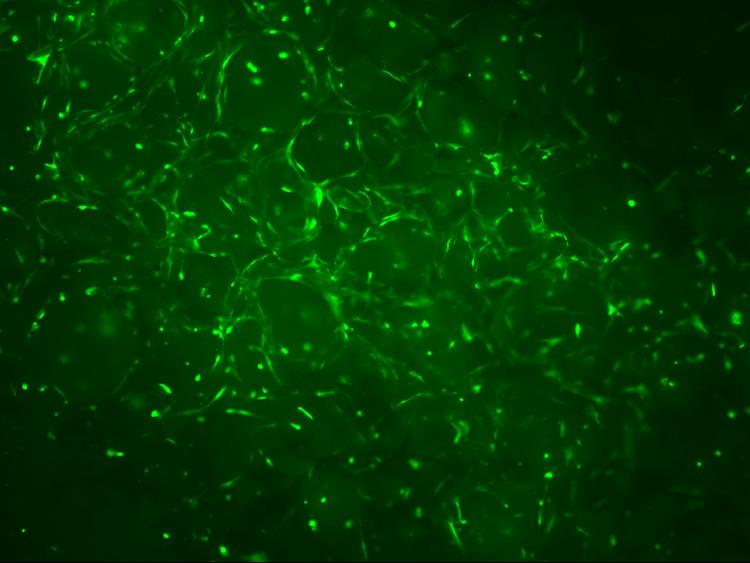
2. ábra Porózus vázanyagba benőtt sejtek fluoreszcens mikroszkópi felvételeken (4x, illetve 60x nagyításban)
Várható impakt, további kutatás
Munkám során sikerült olyan biokompatibilis keverékeket és kompozitokat előállítani, amelyek megfelelő mechanikai tulajdonságokkal rendelkeznek ahhoz, hogy alkalmassá váljanak a csont porózus állományának ideiglenes pótlására, regenerációjának elősegítésére. Ezen vázanyagoknak nagy kiterjedésű traumás sérülések, születési vagy daganatos elváltozások kezelése során egyaránt jelentősége lehet. A fokozott szívósságú polimer keverékek az implantátum töredezését hátráltathatják, így csökkentve a szemcsék betokozódásának veszélyét. A bioaktív sókkal töltött kompozitok viszont a gyulladásos reakciókat csökkenthetik.
A továbbiakban a polimer keverékek szívósságát és a kompozitok bioaktivitását kívánom ötvözni. Tervezem a már megkezdett in vitro biokompatibilitási és lebomlási vizsgálatok folytatását, melyeket megfelelő eredmények esetén in vivo kísérletekkel is kiegészítenék.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk:
Tuba F., Oláh L., Nagy P., Characterization of reactively compatibilized poly(D,L-lactide)/poly(ε-caprolactone) biodegradable blends by essential work of fracture method, Engineering Fracture Mechanics, (javításokkal elfogadva)
Tuba F., Oláh L., Nagy P., Essential work of fracture study of polymers – a novel criterion for the validation of tested ligament range, Journal of Materials Science, (javításokkal elfogadva)
Tuba F., Oláh L., Nagy P., Characterization of fracture properties of aragonite and calcite filled poly(ε-caprolactone) by essential work of fracture method, Journal of Applied Polymer Science, 120(5), 2587–2595 (2011)
Oláh L., Tuba F., Investigation of calcium carbonates enhanced poly(ε-caprolactone) materials for biomedical applications, Macromolecular Symposia, 296(1), 371–377 (2010)
Szenti A., Tuba F., Kovács N.K., Rapid Tooling technologies in the processing of thermoplastic polymers, Materials Science Forum, 659, 97–102 (2010)
Tuba F., Borbás L., Nagy P., Oláh L., Hydrolysis induced deterioration of compressive properties of poly(e-caprolactone), FME Transactions, 37(1), 33–37 (2009)
Tuba F., Borbás L., Oláh L., Hadzima B., Development of polymer based scaffolds for guided tissue regeneration, Proceedings of the Third Hungarian Conference on Biomechanics (ISBN 978 963 06 4307 8), 379–386 (2008).
Tuba F., Oláh L., Lebomló polimer alapú csontpótló implantátum fejlesztése, Műanyag és Gumi, 44(4), 171–174 (2007)
Hivatkozások:
[1] Vacanti J.P., Langer R., Tissue engineering:
the design and fabrication of living replacement devices for surgical
reconstruction and transplantation, The Lancet, 354, S32–S34 (1999)
[2]
Bergsma J.E., de Bruijn W.C., Rozema F.R., Bos R.R.M., Boering G., Late
degradation tissue response to poly(L-lactide) bone plates and screws,
Biomaterials, 16, 25–31 (1995)
[3] Manó S., Novák L., Csernátony Z., A 3D
nyomtatás technológiájának alkalmazása a cranioplasticában. Biomechanica
Hungarica, 1, 15–20 (2008)
[4] Oláh L., Filipczak K., Jaegermann Z., Czigány
T., Borbás L., Sosnowski S., Ulanski P., Rosiak J.M., Synthesis, structural and
mechanical properties of porous polymeric scaffolds for bone tissue regeneration
based on neat poly(ε-caprolactone) and its composites with calcium carbonate,
Polymers for Advanced Technologies, 17, 889–897 (2006)
[5] Bárány T., Czigány T., Karger-Kocsis J., Application of the essential work of fracture (EWF) concept for polymers, related blends and composites: A review, Progress in Polymer Science, 35, 1257–1287 (2010)
Linkgyűjtemény:
BME Biomechanikai Kooperációs
Kutatóközpont

