 |
BMe Kutatói pályázat |

|
BME Oláh György Doktori Iskola
BME VBK, Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Huszthy Péter
Fentiazin egységet tartalmazó szenzor- és szelektormolekulák szintézise és vizsgálata
A kutatási téma néhány soros bemutatása
Napjainkban a szigorodó követelmények egyre szelektívebb analitikai módszereket igényelnek, például a klinikai kémiában, az ipar számos területén, vagy a környezetvédelemben. Megoldást jelenthet erre a problémára a szelektív komplexképzési tulajdonságokkal rendelkező szenzor- és szelektormolekulák kifejlesztése.
A kutatóhely rövid bemutatása
A BME Szerves Kémia és Technológia Tanszékének Dr. Huszthy Péter vezette kutatócsoportjában heterociklus egységet tartalmazó koronaéterek és semleges anionszenzorok szintézisével foglalkozunk. Az új származékok előállításán túl tanulmányozzuk azok molekuláris felismerőképességét, valamint szenzor- és szelektormolekulaként történő alkalmazhatóságukat.
A kutatás történetének, tágabb kontextusának bemutatása
A szenzor- és szelektormolekulák szelektív komplexképzésének alapja a molekuláris felismerés jelensége, mely során egy gazdamolekula az őt körülvevő vendégmolekula-halmazból kiválaszt egyet, és azzal egy másodlagos kötőerőkkel összetartott komplexet alkot [1]. A molekuláris felismerés általános jelenség a természetben, melyre példaként a természetes ionoforok (1. ábra) működését szeretném említeni.
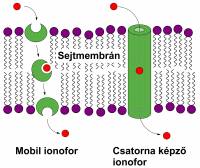
1. ábra Természetes ionoforok működése
Az első szintetikus gazdamolekulákat, a koronaétereket Pedersen fedezte fel 1967-ben, amikor melléktermékként izolálta a dibenzo-18-korona-6-étert [2]. Ezt követően számos ciklikus poliétert szintetizált, és felismerte, hogy ezek a koronaéterek üregméretüktől függően eltérő stabilitású komplexet képeznek kémiailag hasonló fémionokkal. A koronaéterek szelektivitása növelhető a gyűrű merevségének növelésével, mivel ekkor a gazdamolekula bizonyos vendégmolekulákkal szemben előrendezetté válik, ami azt jelenti, hogy a komplex kialakításához kisebb konformációváltozásra van szükség. A makrociklus merevebbé tétele megvalósítható például három kondenzált gyűrűt tartalmazó heterociklusos egység beépítésével. Ezek a vegyületek a legtöbb esetben kromo- vagy fluorogének, így komplexképzésük az igen érzékeny fotofizikai módszerekkel is vizsgálhatóak. Ráadásul a heterociklus donoratomjának tulajdonságai változtathatóak az aromás gyűrűk szubsztitúciójával.
A természetben több olyan fehérje található, mely hidrogénkötéssel képes anionokat komplexálni. Példa erre a Salmonella Typhimuriumból izolált szulfát-kötő fehérje (2. ábra), mely a baktériumban a szulfátion aktív transzportjáért felelős [3]. A természetes példákhoz hasonlóan számos olyan semleges anionszenzor-molekula szintéziséről és vizsgálatáról számoltak be, melyek az anionokat hidrogénkötés segítségével komplexálják [4].
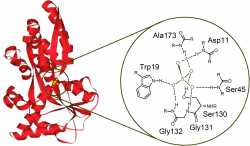
2. ábra Szulfát-kötő fehérje
A kutatás célja, a megválaszolandó kérdések
Korábbi munkám során akridon és akridin egységet tartalmazó makrociklusok szintézisével és vizsgálatával foglalkoztam [A–D]. Figyelmünk ezután a fentiazin felé fordult, így olyan fentiazin egységet tartalmazó koronaéterek előállítását tűztük ki célul, melyben a fentiazin nitrogénatomja a makrogyűrű része. Az ilyen típusú makrociklusok várhatóan alkalmasak biológiai szempontból fontos fémionok szelektív komplexképzésére, így szenzormolekulaként alkalmazhatóak. Emellett a fentiazin aromás gyűrűire különböző szubsztituenseket helyezve, illetve a kénatom oxidációs állapotának változtatásával a fentiazin NH-csoportjának koordinációs tulajdonságai széleskörűen változtathatók, így többféle feladatra alkalmas származékok előállítására nyílik lehetőség.
A koronaéterek prekurzorainak előállítása során olyan származékhoz jutottunk, mely lehetőséget nyújt fentiazin egységet tartalmazó anionreceptor-molekulák előállítására. Az új potenciális szenzormolekulák szintézisén túl célul tűztük ki komplexképzési tulajdonságaik UV–látható spektroszkópiás módszerrel történő vizsgálatát.
Módszerek
A szintetikus munka során preparatív szerves kémiai módszereket alkalmaztunk. A reakciók előrehaladását vékonyréteg-kromatográfiával követtük. Az anyagok tisztítására oszlopkromatográfiát, átkristályosítást, illetve eldörzsölést alkalmaztunk. Az anyagok tisztaságának ellenőrzésére vékonyréteg-kromatográfiát, olvadáspontmérést, illetve optikai forgatóképesség-mérést használtunk. Az előállított vegyületek szerkezetét spektroszkópiai módszerekkel (IR, NMR, MS), valamint elemanalízissel igazoltuk.
Az előállított anionszenzorok komplexképzési tulajdonságait UV-látható spektroszkópiával tanulmányoztuk. A vizsgálatokat acetonitriles oldatokkal végeztük. A titrálások során az anionok tetrabutilammónium sóját tartalmazó titráló oldatot (0,001 M, 0,01 M vagy 0,1 M) Hamilton-fecskendővel vagy automata pipettával adagoltuk a receptormolekulát tartalmazó oldathoz. A titrálások elvégzéséhez a szenzormolekulák 20 μM, 10 μM, 5 μM, 4 μM vagy 3,2 μM koncentrációjú oldatát készítettük el (a nagyobb egyensúlyi állandók meghatározásához hígabb oldatban dolgoztunk). A 20 μM-os oldatok (2,5 ml) esetén 1 cm, míg a 3,2–10 μM-os oldatok (10 ml) esetén 4 cm úthosszal rendelkező kvarc küvettában végeztük a titrálást. A komplexek stabilitási (egyensúlyi) állandóit a globális nemlineáris regressziós módszert alkalmazó SPECFIT/32™ programmal határoztuk meg.
Eddigi eredmények
Doktori munkám során a 3,7-di-terc-butilfentiazin nitrálásával, majd a nitrocsoportok továbbalakításával új szintézisutat dolgoztunk ki 1,9-diszubsztituált fentiazinok előállítására. Ezen az úton 20 új 1,9-diszubsztituált fentiazinszármazékot szintetizáltunk, köztük fentiazin egységet tartalmazó koronaétereket (1–4, 3. ábra) és anionszenzorokat (5–9, 3. ábra) [I–V].
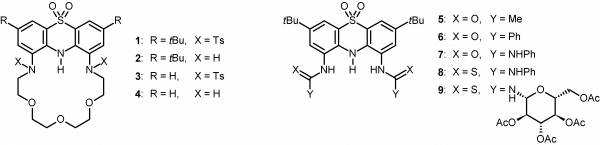
3. ábra Az előállított új koronaéterek és anionszenzorok
A lehetséges szenzormolekulák (5–9) anionokkal szemben mutatott viselkedését UV–látható spektroszkópiával vizsgáltuk acetonitril oldószerben [I, II, IV, V].
Az 5 acetamid és a 6 benzamid anionokkal szemben mutatott viselkedését tetrabutilammónium-fluorid, -klorid, -bromid, -jodid, -hidrogén-szulfát, -dihidrogén-foszfát és -acetát jelenlétében vizsgáltuk. Azt tapasztaltuk, hogy a legtöbb anionnal nem képeztek komplexet, fluorid, acetát és dihidrogén-foszfát jelenlétében pedig mindkét szenzormolekula esetében deprotonálódás történt. Egyszerű hidrogénkötéses komplex kialakulását csak az 5 acetamid kloridionnal történő titrálása során figyeltünk meg (4. ábra). Ecetsav jelenlétében sikerült visszaszorítani az acetátion okozta deprotonálódást, és így kimutatni a hidrogénkötéses komplex jelenlétét [I, II].
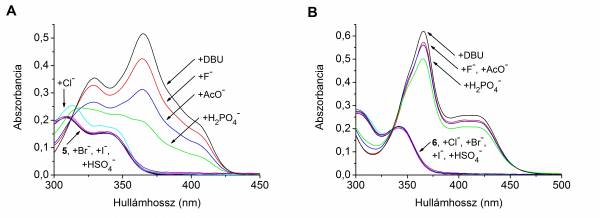
4. ábra Az 5 acetamid (A) és a 6 benzamid (B) oldatának spektrális változásai különböző anionok hatására
Mivel az 5 acetamid és a 6 benzamid komplexképzési tulajdonságai nem voltak megfelelőek, előállítottuk a több kötőhellyel rendelkező 7 karbamidot és 8 tiokarbamidot. Az utóbbi két származék anionokkal szemben mutatott viselkedését tetrabutilammónium-fluorid, -klorid, -bromid, -jodid, -hidrogén-szulfát, -szulfát, -dihidrogén-foszfát, -nitrát és -acetát jelenlétében vizsgáltuk. Mindkét szenzormolekula 1:1 sztöchiometriájú komplexet képzett deprotonálódás nélkül a legtöbb vizsgált anionnal [II, IV].
A szenzormolekulák (7 és 8) oldatához egy ekvivalens fluoridot és acetátot hozzáadva a kompleképződésre jellemző spektrális változásokat tapasztaltunk, további anion adagolásának hatására pedig deprotonálódást figyeltünk meg, azonban a titrálások végpontját jelző spektrumok eltértek a deprotonált szabad szenzormolekula spektrumától. Ez alapján arra következtettünk, hogy a deprotonált szenzormolekulák anionnal alkotott komplexei keletkeztek (5. ábra) [II, IV].
A 7 szenzormolekula fluoridiont tartalmazó oldatából sikerült röntgenkrisztallográfiai vizsgálatokra alkalmas kristályt növesztenünk acetonitril–hexán elegyet alkalmazva oldószerként. A kristály aszimmetrikus egységében a deprotonált szenzormolekula fluoridionnal alkotott komplexe és két tetrabutilammónium ellenion található (5. ábra) [II, IV].

5. ábra A deprotonált szenzormolekula fluoridionnal alkotott komplexe
Az acetilezett glükóz egységeket tartalmazó 9 tiokarbamid enantiomer-szelektivitását mandulasav, terc-butoxikarbonil-védett aminosavak (fenilglicin, fenilalanin, alanin), valamint más védőcsoportokat tartalmazó fenilglicin származékok (formil-, acetil- és pivaloilcsoportot tartalmazó származékok) tetrabutilammónium sóinak enantiomerjei között vizsgáltuk. A szenzormolekula közepes enantiomer-szelektivitást mutatott (terc-butoxikarbonil-védett fenilglicin esetében Δ log K = 0,22) [II, V].
Várható impakt, további kutatás
A 2 és 4 makrociklusok szekunder aminocsoportjai lehetőséget nyújtanak arra, hogy ezeket alkilezve, illetve acilezve különböző célokra alkalmas új szenzor- és szelektormolekulákat állíthassunk elő. Tervezzük ezen koronaéterek továbbalakítását, valamint molekuláris felismerőképességük vizsgálatát.
A 7 karbamid és a 8 tiokarbamid esetében tapasztalt eredmények alapján olyan új szenzormolekula tervezhető, mely alkalmas lehet fluoridion szelektív meghatározására bázikus közegben.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája
- Kormos, A.; Móczár, I.; Sveiczer, A.; Baranyai, P.; Párkányi, L.; Tóth, K.; Huszthy, P., Tetrahedron 2012, 68, 7063–7069. old.
- Kormos, A.; Huszthy, P., Magyar Kémiai Folyóirat, 2013, közlésre elfogadva.
- Kormos, A.; Sveiczer, A.; Fődi, T.; Rohonczi, Á.; Huszthy, P., Arkivoc, 2013, közlésre elfogadva.
- Kormos, A.; Móczár, I.; Pál, D.; Baranyai, P.; Holczbauer, T.; Palló, A.; Tóth, K.; Huszthy, P., Tetrahedron, visszaküldve az újsághoz a kért módosításoknak megfelelően.
- Kormos, A.; Móczár, I.; Pál, D.; Baranyai, P.; Kupai, J.; Tóth, K.; Huszthy, P., Tetrahedron: Asymmetry 2013, 24, 62–65. old.
További saját publikációk
- Kertész, J.; Huszthy, P.; Kormos, A.; Bertha, F.; Horváth, V.; Horvai, G., Tetrahedron: Asymmetry 2009, 20, 2795–2801. old.
- Kertész, J.; Móczár, I.; Kormos, A.; Baranyai, P.; Kubinyi, M.; Tóth, K.; Huszthy, P., Tetrahedron: Asymmetry 2011, 22, 684–689. old.
- Kertész, J.; Huszthy, P.; Kormos, A.; Bezúr, L., Tetrahedron 2011, 67, 5206–5212. old.
- Kertész, J.; Bognár, B.; Kormos, A.; Móczár, I.; Baranyai, P.; Kubinyi, M.; Kálai, T.; Hideg, K.; Huszthy, P., Tetrahedron 2011, 67, 8860–8864. old.
Linkgyűjtemény
Anionszenzorok (angol)
Fentiazin (angol)
Hivatkozások listája
- Steed, J. W.; Atwood, J. L., Supramolecular Chemistry 2009, Wiley, 2nd ed.
- Pedersen, C. J., J. Am. Chem. Soc. 1967, 89, 2495–2496; 7017–7036. old.
- Pflugrath, J. W.; Quiocho, F. A., J. Mol. Biol. 1988, 200, 163–180. old.
- Wenzel, M.; Hiscock, J. R.; Gale, P. A. Chem. Soc. Rev. 2012, 41, 480–520. old.
