|
|
BMe Kutatói pályázat |
|
Pszichológia Doktori Iskola (Kognitív Tudomány)
BME TTK Kognitív Tudományi Tanszék, MTA TTK Hálózat és Viselkedés Neurobiológia kutatócsoport
Témavezető: Dr. Mátyás Ferenc
Az alvás-ébrenlét kontrollja
A kutatási téma néhány soros bemutatása
Az éberség és az alvás-ébrenlét megfelelő kontrollja az egyik legfontosabb eleme a viselkedésszabályozásnak. Ha agyunk az optimálisnál kevésbé éber, az unalomhoz, figyelemhiányhoz, álmossághoz vagy szélsőséges esetben akár kómához is vezethet. Másrészről viszont egy túlstimulált agy stresszt, szorongást vagy pánikot válthat ki. Időnként fontos, hogy kialakuljanak ezek az állapotok, de más élethelyzetekben kifejezetten hátrányosak lehetnek. Például mind a nyugodtság, mind az enyhe stressz hozzájárulhat ahhoz, hogy jól teljesítsünk egy teszten. Ugyanakkor, egy felkészült, de túlzottan stresszes, vagy éppen álmos diák nagyobb eséllyel bukik meg ugyanezen a vizsgán1. Emellett napjainkban az alvással összefüggő rendellenességek - mint például az inszomnia - előfordulása egyre gyakoribb a fejlett országokban. Ezért nagyon fontos, hogy megértsük, hogy hogyan kontrollálja az agyunk ezeket az éberséggel összefüggő folyamatokat.
A kutatóhely rövid bemutatása
A Hálózat és Viselkedés Neurobiológia kutatócsoportot dr. Mátyás Ferenc alapította az MTA TTK-n 2015-ben. A kutatócsoport leginkább különböző érzelem- és viselkedésszabályozási agyi folyamatok (pl. alvás-ébrenlét, félelem) sejt-specifikus felderítésével foglalkozik. A csoportban jelenleg anatómiai, elektrofiziológiai és viselkedéses kísérletek is zajlanak, melyeket multidiszciplináris megközelítéssel vizsgálunk, kísérleti modellállatként egereket használva.
A kutatás történetének, tágabb kontextusának bemutatása
Már évtizedekkel ezelőtt felvetették, hogy az úgynevezett talamusz (egy ősi agyi struktúra az agy középső részén) középső (mediális) része fontos szerepet játszik az éberség agyi szabályozásában2. Az első kísérletekből, amelyek ezt a felvetést vizsgálták azt az eredményt kapták a kutatók, hogy a mediális talamusz (MT) elektromos stimulációja az agykérgi aktivitás deszinkronizációjához vezet, ami tulajdonképpen az ébrenlét elektrofiziológiai definíciója3. Ezzel összhangban áll az, hogy ennek a területnek az úgynevezett mélyagyi stimulációja jelentős motoros és kognitív fejlődést eredményezett kómás betegeknél4 (1. ábra).
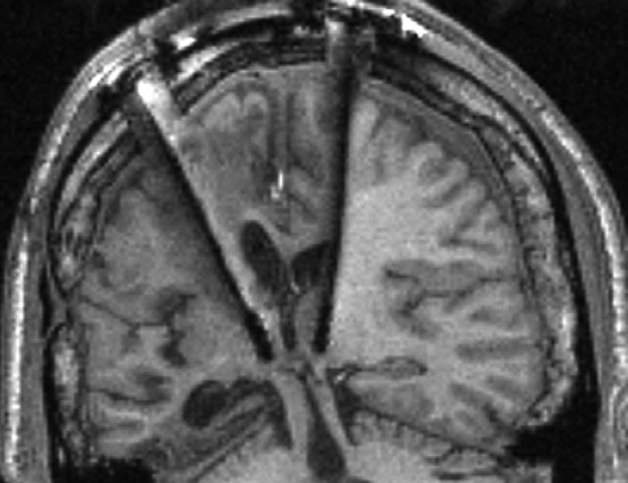
1. ábra. A MT mélyagyi stimulációja egy kómás betegben. A stimuláló elektródák a kép közepén láthatók. A beteg motoros és kognitív képességei ideiglenesen jelentősen javultak a MT stimulációját követően. Forrás: N. D. Schiff et al., 2007
Ugyanakkor az elektromos stimuláció egy nem-specifikus kísérleti megközelítés. Ez azt jelenti, hogy ennek a módszernek az alkalmazása során a kutatók nem lehetnek biztosak abban, hogy pontosan mi a forrása a viselkedés megváltozásának (pl. a felébredésnek). Az elektromos stimuláció ugyanis több sejt-típust is érinthet egyszerre, de akár szomszédos agyterületek működését is megváltoztathatja (2. ábra). Talán ez az oka annak, hogy az ilyen terápiák hatékonysága viszonylag alacsony, és továbbra sem terjedtek el széleskörűen. Ugyanez igaz más, gyakran használt kísérleti módszerekre, például a léziókra (agyterületek kivágása/roncsolása) vagy a gyógyszeres aktiválásra/gátlásra. Ebből kifolyólag a mai napig nem teljesen világos, hogy a talamusz mely sejtjei felelősek az éberség szabályozásáért. Kutatócsoportunkban ezért különböző modern kísérleti módszerek kombinálásával (pl. genetikailag módosított egértörzsek, speciális vírusok) próbáltuk meghatározni az éberség szabályozásának talamikus forrását.
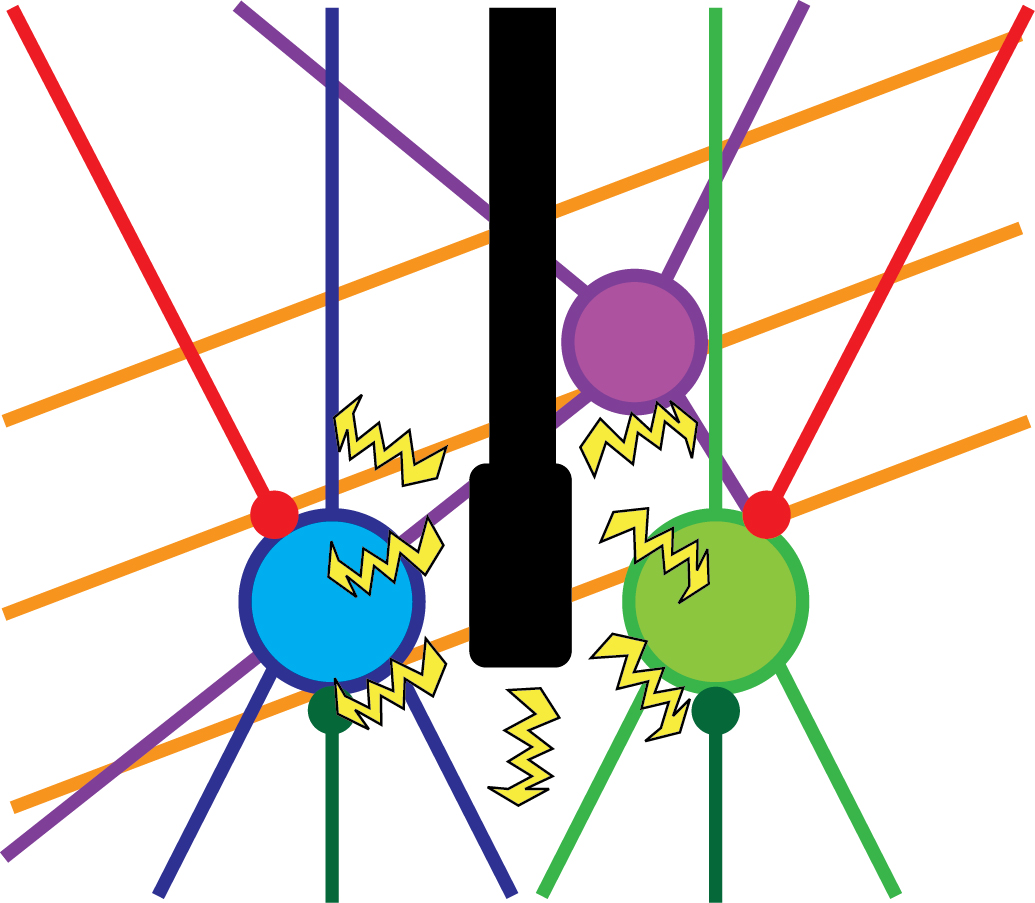
2. ábra. Nem-specifikus kísérleti megközelítések. Egy agyterületen több különböző idegsejt-típus is előfordulhat (kék, zöld, lila), például gátló és serkentő sejtek egymás mellett. Ezenkívül minden agyterületre érkeznek axonok (sötétzöld, piros vonalak) más területekről. Ráadásul előfordulhatnak áthaladó axonok (narancssárga vonalak) is. Az elektromos stimuláció ezeket mind érinteni fogja, így szinte lehetetlen meghatározni a viselkedési változás pontos forrását. Saját ábra.
A kutatás célja, a megválaszolandó kérdések.
A korábbi kísérletekkel sikerült felderíteni, hogy a mediális talamusz (MT) egy sor olyan agyterülettel áll kapcsolatban, amelyek fontos szerepet játszanak az éberséggel különböző összefüggő folyamatokban. A legfontosabbak ezek közül a prefrontális kéreg (PFC, az öntudatért és az érzelemszabályozásért felelős agyterület), az amygdala (Amy, érzelmi tanulás) és az ún. nucleus accumbens (NAc, jutalmazás, motiváció)5-7. Kutatásaink fő célja az volt, hogy azonosítsunk egy olyan genetikai markert, ami specifikusan jellemző az ezeket az agyterületeket beidegző MT-sejtekre. Ilyen marker nélkül ugyanis szinte lehetetlen ezeknek az MT-magoknak a vizsgálata, mivel (különösen egerekben) rendkívül apró, szabálytalan alakú magokról van szó, amelyek ráadásul egy funkcionálisan nagyon változatos környezetben helyezkednek el. A megfelelő marker azonosításával azonban lehetőség nyílik az MT sejt-specifikus anatómiai, elektrofiziológiai és viselkedéses vizsgálatára.
Módszerek
Az első kísérletek során ún. klasszikus pályajelöléses módszereket alkalmaztunk, hogy meghatározzuk a fent említett agyterületek (PFC, Amy, NAc) talamikus beidegzésének forrását. Ezekben a kísérletekben vékony üvegpipetták segítségével különböző pályajelölő anyagokat juttatunk ezekre az agyterületekre élő állatokban (3. ábra). Egy hét után az állatokból nyert agyszövet-mintákon megvizsgálhattuk, hogy hol helyezkednek el a jelölt sejtek. Érdekes módon az ezeket az agyterületeket beidegző sejtek túlnyomó többsége egy kálciumkötő fehérjét, az ún. calretinint (CR) kifejező sejtek között helyezkedett el a MT-ban. Erős nagyítású mikroszkóppal megvizsgálva azt az eredményt kaptuk, hogy ezeknek a sejteknek a túlnyomó többsége (~95%) maga is kifejezte a CR fehérjét. További kísérletekkel azt is sikerült igazolni, hogy ezek a CR-expresszáló MT-sejtek specifikusan aktiválódnak különböző éberségi szinteket igénylő helyzetekben (pl. az állatok kézbevétele, gyenge elektromos sokk). A CR-t tehát mint az éberségre érzékeny MT-specifikus genetikai markert sikerült azonosítanunk (4. ábra).
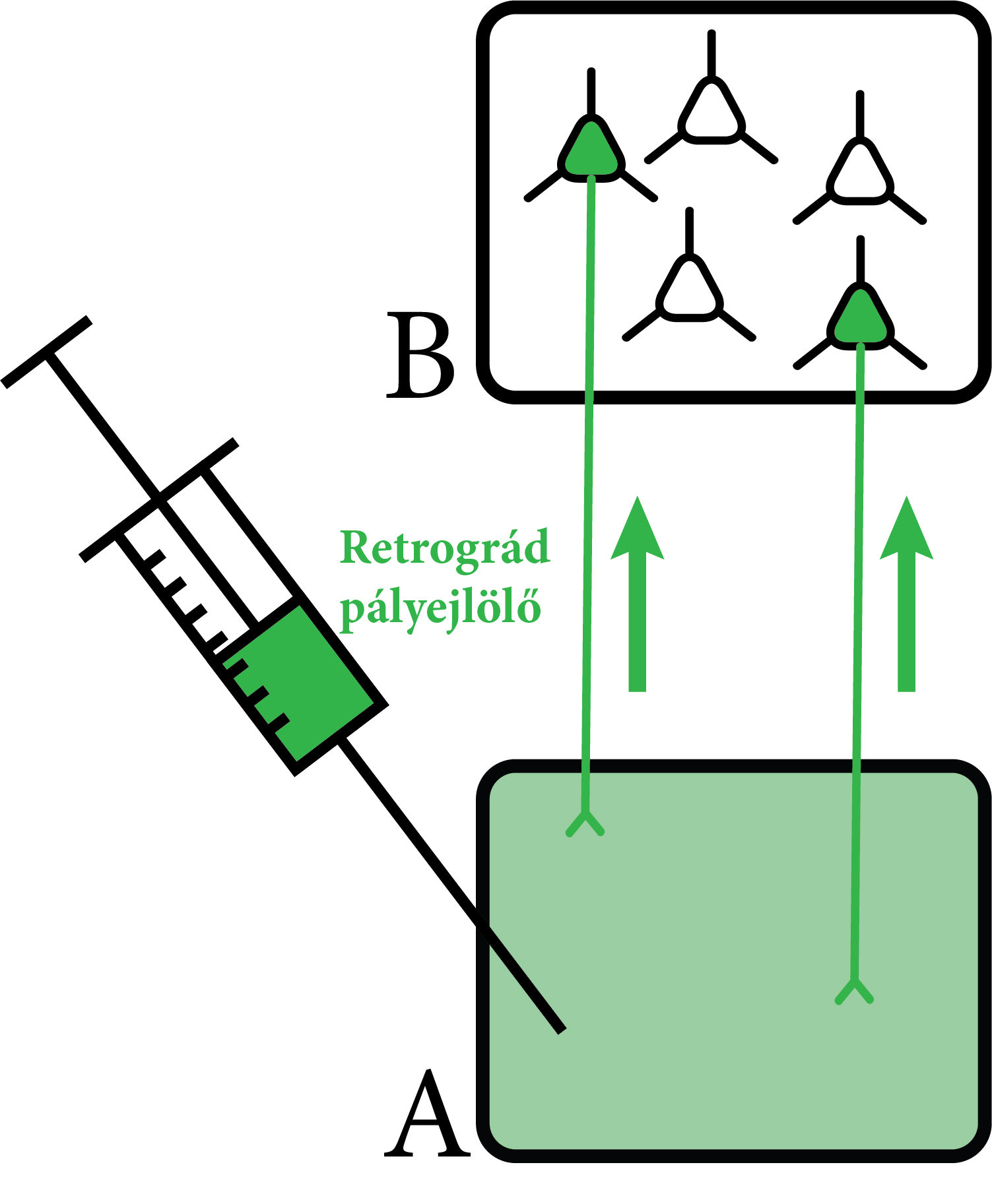
3. ábra. Retrográd pályajelölés. Ezekben a kísérletekben egy jelölőanyagot (zöld) juttatunk a vizsgálni kívánt agyterületre (A). Ezt a jelölőanyagot az ide vetítő sejtek axonjai felveszik és visszaszállítják (zöld nyilak) a sejttestjeikbe, melyek más agyterületeken helyezkednek el (B). Ezzel a módszerrel meghatározható tehát egy adott agyterületet beidegző sejtek elhelyezkedése. Saját ábra.
Ennek a markernek az ismeretében sejt-specifikus megközelítésekkel is elkezdhettük vizsgálni a MT-t. Először beszereztünk egy specifikus genetikailag módosított egértörzset, az ún. calretinin-Cre (CR-Cre) törzset. Ezekben az állatokban a CR-kifejező sejtek (és csak ezek a sejtek) kifejeznek egy másik speciális fehérjét, egy “molekuláris ollót”. Ez az “ollófehérje” nem befolyásolja a sejteket a normális működésben, de képes különböző, kívülről mesterségesen bejuttatott működésképtelen DNS-szálak “elvágására”, így téve működőképessé azokat.
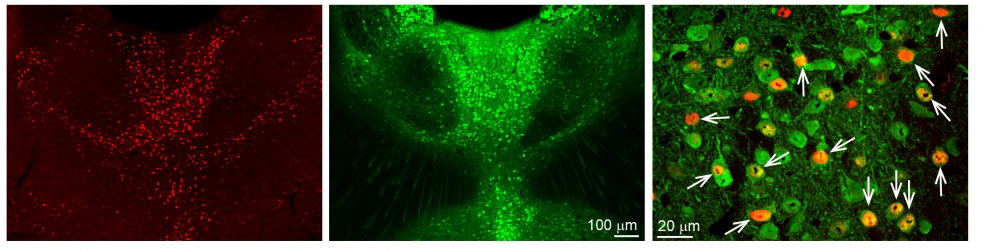
4. ábra. Éberség hatására aktiválódó calretinin-sejtek. Egy speciális géntermék (cFos) kimutatásával azonosíthatók az ébrenlét során aktív idegsejtek. Az éberség hatására aktiválódott (cFos kifejező) sejtek piros színnel láthatók a MT-ban (első panel). A calretinin kifejeződése (zöld) nagyfokú átfedést mutat ezekkel az éberség során aktiválódó sejtekkel (második panel). A nagyobb nagyítású képen (harmadik panel) látható a két sejtpopuláció nagyfokú átfedése (fehér nyilak). Forrás: MTA KOKI
A speciális egértörzsön kívül szükségünk volt még speciális vírusokra is, amelyek a szükséges fehérjék génjeit (pl. fluoreszcens fehérjék génjeit) hordozták a DNS-ükben. Ha ezeket a vírusokat bejuttatjuk a CR-Cre egerek agyába, akkor azok csak a CR-kifejező sejteket képesek megfertőzni (hiszen csak ezekben van jelen a szükséges “molekuláris olló”), a többi sejtet érintetlenül hagyják. Ezekben a sejtekben tehát kifejeződik a vírus által hordozott speciális gén, a többi sejtben pedig nem történik semmi. A módszer összefoglalását az 5. ábrán láthatjuk.

5. Ábra. A sejt-specifikus megközelítés. Speciális (genetikailag módosított) egértörzsekben bizonyos sejtek (pl. a calretinint kifejező sejtek) kifejezik a Cre-fehérjét is (narancssárga), amely egyfajta “molekuláris ollóként” működik. Speciális vírusok bejuttatása után ezekben a sejtekben kifejeződik a vírus által hordozott géntermék (pl. egy fluoreszcens fehérje, zöld). Az állatok összes többi sejtjei ezalatt teljesen érintetlen marad. Saját ábra.
Ezeknek a kísérleti eszközöknek a birtokában először egy olyan vírust juttattunk be a kísérleti állatok agyába, amelyik egy fluoreszcens (világító) fehérje génjét hordozta. Így szelektíven megjelölhettük a CR-kifejező sejteket a MT-ban és azok axonjait is (az idegsejtek hosszú nyúlványai, amelyek másik agyterületek beidegzéséért felelősek). Ezek után megvizsgálhattuk a sejtek és az axonok elhelyezkedésért az egész agyban.
Az anatómiai kísérleteken túl specifikus viselkedéses kísérleteket is végeztünk a CR-Cre egértörzsben. Ehhez először egy hasonló vírust injektáltunk a kísérleti állatok MT-ába, de ez a vírus egy fényérzékeny ioncsatorna génjét hordozta. Az ioncsatornák azok a molekulák a sejtmembránban, amelyek az ionok (töltött részecskék) ki- és beengedéséért, végső soron a megfelelő ioneloszlás fenntartásáért felelősek. Tulajdonképp ez az ioneloszlás képezi az idegsejtek elektromos kommunikációjának alapját. A fényérzékeny ioncsatornák annyiban speciálisak, hogy csak megfelelő hullámhosszúságú fény hatására nyitnak és zárnak. Ezért apró optikai szálakat ültettünk be a kísérleti állatok MT-ába, amelyek segítségével a megfelelő hullámhosszúságú fényt juttathattuk el ezekhez a csatornafehérjékhez. Így végső soron nagy tér- és időbeli precizitással képesek voltunk aktiválni vagy gátolni az MT-sejteket, különböző éberségi helyzetet igénylő szituációkban, például alvás vagy felderítő viselkedés közben. Ezt a technikát specifikus optogenetikának nevezik (6. ábra).
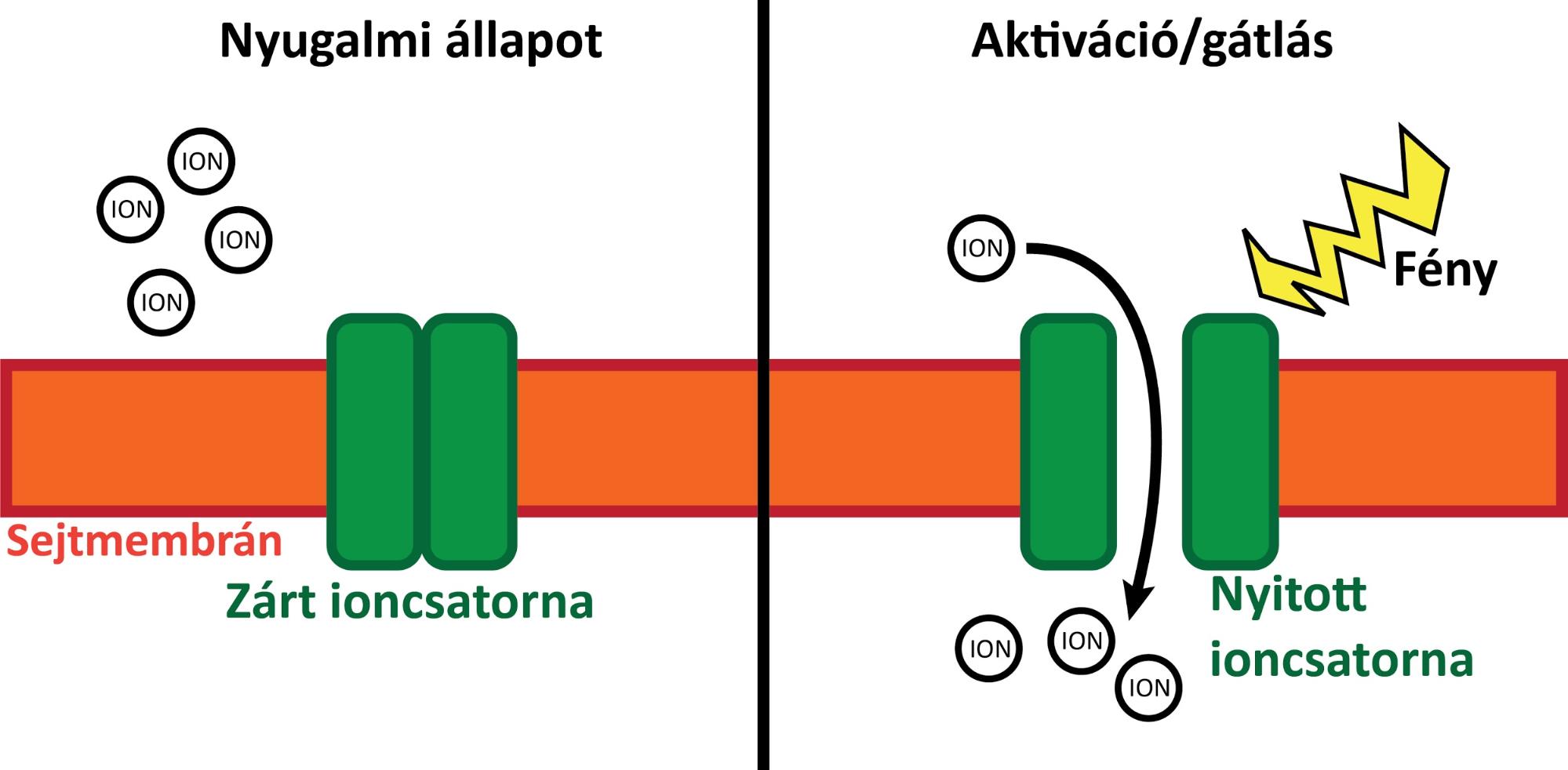
6. ábra. Optogenetika. Nyugalmi állapotban (balra) az idegsejtek membránjában (narancssárga) elhelyezkedő fényérzékeny ioncsatornák (zöld) zárt állapotban vannak, és nem befolyásolják a normális sejtműködést. Megfelelő hullámhosszúságú fény (sárga) hatására (jobbra) az ioncsatornák kinyílnak, így szabaddá válik az ionok (töltött részecskék) áramlása a sejtmembrán két oldala között. Ez a folyamat (az ioncsatorna típusától függően) a sejt aktivációjához vagy gátlásához vezet. Saját ábra.
Eddigi eredmények
A sejt-specifikus anatómiai kísérletek segítettek felderíteni a CR-expresszáló MT-sejtek axonjainak elhelyezkedését, úgynevezett vetítési mintázatát. Az axonvégződések rendre a PFC, az Amy és a NAc, illetve más, a szakirodalomban korábban meghatározott területeken helyezkedtek el. Figyelembe véve, hogy a MT által beidegzett területek mind részét képezik az agy viselkedést és érzelmeket szabályozó rendszerének (az úgynevezett limbikus rendszernek), és azt, hogy az MT-sejtek képesek egyszerre befolyásolni ezeknek a területeknek az aktivitását, az MT sejtjei ideális jelöltek lehetnek egy központi éberség-szabályozó gócpont szerepére.
Ennek a megvizsgálására a korábban említett specifikus optogenetikai módszert alkalmaztuk. A kísérleti állatokat először egy természetes felderítő viselkedés közben teszteltük. Megfelelő hullámhosszúságú fény segítségével gátoltuk a CR-kifejező MT-sejtek aktivitását a felderítő viselkedés közben, és megfigyeltük, hogy milyen változás következik be a viselkedésben. A kontrollcsoporthoz képest a tesztcsoportban lévő állatok sokkal többször álltak meg a viselkedés közben. Ez az immobilitás magyarázható az éberségi szint csökkenésével, amit az MT sejtek gátlása váltott ki. Más szóval, a CR-sejtek gátlása csökkentette az éberséget, ami nagyobb arányú immobilitáshoz vezetett a felderítő viselkedés közben.
Ezen kívül azt is megvizsgáltuk, hogy milyen hatása van a MT-sejtek aktiválásának alvás közben. A korábbihoz hasonló optogenetikai módszerrel az állatokban aktiváltuk ezeket a sejteket természetes alvás közben. Erős stimuláció hatására az állatok felébredtek, míg a kontroll csoport állatai átaludták a stimulációt. Fontos kiemelni, hogy az állatok felébredése minden elemében hasonlított egy teljesen természetes felébredési folyamathoz. A kísérleti állatok nem mutatták jelét semmiféle stressznek, fájdalomnak vagy félelemnek (7. ábra).
Gyengébb stimuláció hatására az állatok nem ébredtek fel teljesen, csak úgynevezett mikro-ébredéseket mutattak. Ezekben a rövid periódusokban az állatok kis fej- és nyakmozgásokat hajtottak végre, majd néhány másodperc elteltével visszatértek a természetes alváshoz.
Összefoglalásként elmondható, hogy a kísérleteink eredményei szerint a MT CR-kifejező sejtjei szelektíven aktiválódnak fokozott éberséget igénylő helyzetekben. Ezeknek a sejteknek az axonjai pedig különböző agykérgi és kéreg alatti agyi régiókat idegeznek be, mely régiók a viselkedés- és érzelemszabályozás különböző aspektusaiért felelősek. Ennél fogva a MT-sejtek ideális helyzetben vannak ahhoz, hogy egy éberségszabályozó agyi központ szerepét töltsék be. Ennek alátámasztásaként kísérleteinkben bemutattuk, hogy ezeknek a sejteknek a szelektív aktiválása és gátlása az éberségi szint dózisfüggő (pl. erősebb stimuláció – magasabb éberség) emelkedéséhez vagy csökkenéséhez vezet.
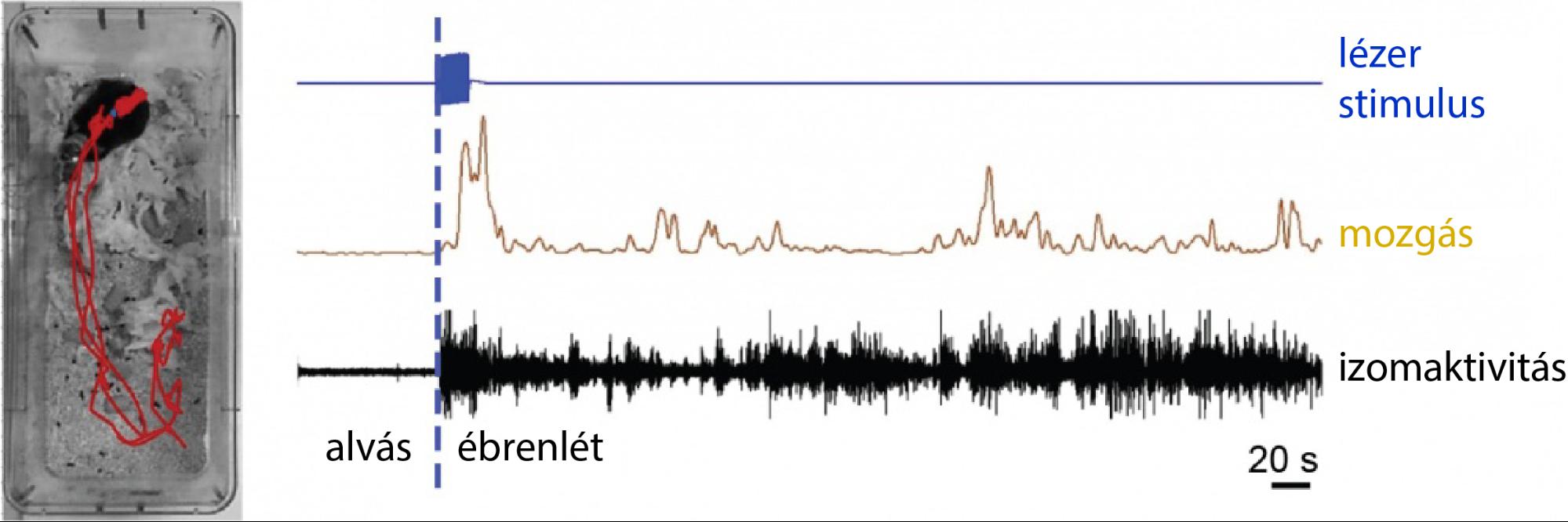
7. ábra. Felébredés a MT-sejtek aktivációját követően. A bal oldali képen látható a kísérleti állat mozgásának útvonala (piros vonal) a CR-kifejező MT-sejtek stimulációja után. A stimuláció előtt az állat aludt. A jobb oldalon látható a lézerstimuláció (kék) után a mozgás-diagram (barna) és a megnövekedett izomaktivitás (fekete). Forrás: MTA KOKI
Várható impakt, további kutatás
Kísérleteink során azonosítottunk egy korábban ismeretlen CR-kifejező sejtpopulációt a MT-ban, amely képes az éberség szabályozására. Mivel ezek a sejtek az emberi agyban is megtalálhatók, és kapcsolatrendszerük is hasonló, eredményeink hozzájárulhatnak az emberi alvás-ébrenlét ciklus pontosabb megismeréséhez is. Egy genetikai/molekuláris marker ismeretében lehetőség nyílik újfajta altatók kifejlesztésére, melyek a természetesebb alvást tudnak kiváltani, mint a jelenleg elérhető szedatív altatók. További kutatások szükségesek ahhoz, hogy még pontosabban megismerjük ezeket a sejteket és a működésüket. Különböző specifikus receptorok vagy más molekuláris jellemzők felderítése például új gyógyszer-célpontok azonosításához segíthet hozzá.
Saját publikációk, hivatkozások, linkgyűjtemény
Tudományos publikációk:
A highly collateralized thalamic cell type with arousal-predicting activity serves as a key hub for graded state transitions in the forebrain
Mátyás, F. ; Komlósi, G. ; Babiczky, Á. ; Kocsis, K. ; Barthó, P. ; Barsy, B. ; Dávid, C. ; Kanti, V. ; Porrero, C. ; Magyar, A. ; Szűcs, I. ; Clasca, F. ; Acsády, L
NATURE NEUROSCIENCE 21 : 11 pp. 1551–1562. , 12 p. (2018)
DOI: https://doi.org/10.1038/s41593-018-0251-9
Plastic multimodal signaling of a thalamo-amygdala pathway controls associative behavior
Boglárka Barsy; Kinga Kocsis; Aletta Magyar; Ákos Babiczky; Mónika Szabó; Judit M. Veres; Daniel Hillier; István Ulbert; Ofer Yizhar; Ferenc Mátyás (előkészületben)
Ismeretterjesztő publikációk:
Függőségi helyzetjelentés – Interjú Demetrovics Zsolt addiktológussal
National Geographic Magyarország Online,
2019.06.04.
Három tévhit agyunk működéséről
National Geographic Magyarország Online,
2019.03.25.
Évek óta dolgozom kísérleti egerekkel. De mit szólnak ehhez az állatvédők?
Qubit.hu,
2019.03.01.
Górcső alatt az
állatkísérletek: tudományos érvek és állatvédelem
Tudományos eredmények a nagyvilágból – Válogatás a Campus Mundi ösztöndíjasok
tanulmányaiból (2018)
Sírás és
nevetés, avagy a félelmi- és a jutalmazási rendszer az agyban 3/3
National Geographic Magyarország Online,
2018.12.30.
Jutalmazás,
dopamin és az agy - Félelem és jutalmazás az agyban ⅔
National Geographic Magyarország Online,
2018.09.20.
Hogyan fél az agyunk? Félelem és jutalmazás az agyban ⅓
National Geographic Magyarország Online, 2018.05.24.
Linkgyűjtemény
Az MTA.hu beszámolója a kutatási eredményekről
Az Index.hu beszámolója a kutatási eredményekről
Optogenetika (angol nyelvű videó)
Pályajelölési eljárások (angol nyelvű videó)
Az alvás neurobiológiája (angol nyelvű videó)
Hivatkozások listája:
1. R. M. Yerkes, J. D. Dodson, The relation of strength of stimulus to rapidity of habit-formation. J. Comp. Neurol. Psychol. 18, 459–482 (1908).
2. Y. D. Van der Werf, M. P. Witter, H. J. Groenewegen, The intralaminar and midline nuclei of the thalamus. Anatomical and functional evidence for participation in processes of arousal and awareness. Brain Res. Brain Res. Rev. 39, 107–40 (2002).
3. R. Morison, E. Dempsey, A study of thalamo-cortical relations. Am. J.Physiol. 135, 281–292 (1941).
4. N. D. Schiff et al., Behavioural improvements with thalamic stimulation after severe traumatic brain injury. Nature. 448, 600–3 (2007).
5. R. P. Vertes, W. B. Hoover, Projections of the paraventricular and paratenial nuclei of the dorsal midline thalamus in the rat. J. Comp. Neurol. 508, 212–37 (2008).
6. W. B. Hoover, R. P. Vertes, Collateral projections from nucleus reuniens of thalamus to hippocampus and medial prefrontal cortex in the rat: a single and double retrograde fluorescent labeling study. Brain Struct. Funct. 217, 191–209 (2012).
7. R. P. Vertes, S. B. Linley, W. B. Hoover, Limbic circuitry of the midline thalamus.
Neurosci. Biobehav. Rev. (2015), doi:10.1016/j.neubiorev.2015.01.014.
