|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME Vegyészmérnöki és Biomérnöki Kar, Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Csontos István
Méretnövelt elektrosztatikus szálképzés alkalmazása a gyógyszeriparban
A kutatási téma néhány soros bemutatása
Az elmúlt évtizedekben a biohatóanyagok robbanásszerű növekedésének lehettünk szemtanúi a gyógyszeriparban. A biohatóanyagok szárítása terén áttörést jelenthet az elektrosztatikus szálképzés, mivel kiválthatja a jelenleg elterjedt fagyasztva szárítást, mely drága, szakaszos, és gyakran az érzékeny hatóanyagok bomlását okozza. Az elektrosztatikus szálképzés előnye, hogy kíméletes, szobahőmérsékleten történő szárítással teszi lehetővé nano- vagy mikroszálas szilárd formulációk előállítását folyamatos üzemben. Az ipari alkalmazás szempontjából azonban elengedhetetlen a módszer méretnövelése, illetve az előállított szálak feldolgozása végső gyógyszerformává.
Emiatt munkám során feldolgozható szálak fejlesztését és különböző típusú biohatóanyagok (fehérjék, egész sejtek) méretnövelt szálképzését tűztem ki célul.
A kutatóhely rövid bemutatása
A FirePharma kutatócsoport a gyógyszeripar területén innovatív kontrollált, folyamatos és integrált gyógyszer-technológiák fejlesztésével foglalkozik. A csoportunk nagy hangsúlyt fektet a hazai és nemzetközi ipari kapcsolatok kiépítésére; jelenleg is aktív együttműködést tartunk fenn a magyar gyógyszergyárak többségével, illetve külföldi gyógyszercégekkel is.
A kutatás történetének, tágabb kontextusának bemutatása
A biohatóanyagok óriási térnyerését a gyógyszeriparban jól szemlélteti, hogy 2018-ban a világ 20 legnagyobb árbevételt generáló gyógyszere közül 14 biohatóanyag volt. A biohatóanyagok éves forgalma 2017-ben közel 190 milliárd dollár volt, ami az előrejelzések szerint 2025-re meghaladhatja az 500 milliárd dollárt is [1].
A biogyógyszerek fejlesztése nagyon sok kihívással jár, mivel e hatóanyagok vizes közegben kis stabilitásúak. Köztitermék vagy a végtermék stabilizálására megoldást jelenthet a biohatóanyagok szárítása, ami általában a stabilitás javítása mellett könnyebb és olcsóbb kezelést, szállítást és tárolást tesz lehetővé [2].
Jelenleg a biohatóanyagok szárítására az iparban leggyakrabban fagyasztva szárítást alkalmaznak a technológia hátrányai ellenére. A fagyasztva szárítás nagyon költség- és időigényes és csak szakaszosan üzemeltethető technológia, amelynél a fagyás során a hatóanyag degradálódhat [3].
Növekvő érdeklődés övezi az elektrosztatikus szálképzést, amely egy új, hatékony, és kíméletes folyamatos technológia biohatóanyagok szárítására. Az elektrosztatikus szálképzés pillanatszerű szárítást tesz lehetővé szobahőmérsékleten, ami az érzékeny biohatóanyagok esetén nagyon nagy előnyt jelent. Emellett egy egyszerű, folyamatos és alacsony energiaigényű, azaz olcsó technológia [4].
Az elektrosztatikus szálképzést leíró publikációk döntő hányada azzal foglalkozik, hogy miként lehet megfelelő tulajdonságú szálakat előállítani, és csupán néhány cikkben található információ a szálak méretnövelt előállításának és a szálak végső gyógyszerformává történő átalakításának lehetőségeiről [5]. A gyógyszeripari alkalmazás szempontjából nagyon fontos lenne vizsgálni, hogy lehetséges-e biohatóanyag-tartalmú őrölhető szálak előállítása nagy mennyiségben, illetve lehetséges-e az őrölt szálak tablettázása. A feldolgozási lépéseknek az érzékeny biohatóanyagokra gyakorolt hatásának vizsgálata ugyancsak alapvető fontosságú.
A kutatás célja, a megválaszolandó kérdések
A kutatásom során célul tűztem ki a vizes oldatok szobahőmérsékleten történő méretnövelt szálképzési lehetőségének vizsgálatát nagy sebességű elektrosztatikus szálképzéssel, polimeres és polimermentes rendszerek esetén. Célom volt továbbá feldolgozható biohatóanyag-tartalmú szálak kifejlesztése és orális szilárd formulációk előállítása a feldolgozott szálas porokból. Vizsgálni szerettem volna a feldolgozási lépések hatása mellett a szilárd formulációk hosszú távú stabilitását is.
Munkám során két különböző típusú modell biohatóanyaggal dolgoztam. Az egyik egy fehérje típusú hatóanyag, a tejcukor-érzékenység kezelésére alkalmazott β-galaktozidáz enzim, a másik pedig a bél mikrobiom egyik fontos tagja, az anaerob Clostridium butyricum baktérium volt. A Clostridium butyricum a bélben vajsavat termel, mely bizonyítottan gyulladáscsökkentő hatással bír.
Módszerek
A Clostridium butyricum tenyésztése 37 °C-on történt anaerob körülmények között. A tenyésztést követően a sejteket centrifugáltam. Az így kapott baktériumszuszpenziót, illetve a másik esetben a β-galaktozidáz enzim vizes oldatát adtam hozzá a polimer vagy ciklodextrin oldatokhoz, amelyekből a szálképzést végeztem.
A szálak nagy léptékű gyártása a kutatócsoportunkban kifejlesztett nagy sebességű elektrosztatikus szálképző (HSES) technológiával történt. A biohatóanyag és a szálképzési mátrix vizes oldatát egy fecskendőpumpával adagoltam egy nagy sebességgel forgó, rozsdamentes acél szálképző fejbe, amely nagyfeszültségre volt kapcsolva. Az elektrosztatikus és centrifugális erők hatására a fejből folyadéksugarak léptek ki, melyek a föld felé haladva elvékonyodtak a nano vagy mikro mérettartományba. A megnövekedett fajlagos felület miatt az oldószer rendkívül gyorsan elpárolgott (< 1 s). A szilárd szálakat vagy egy földelt gyűjtőlemezen vagy speciális begyűjtéssel (pl.: ciklon) gyűjtöttem.
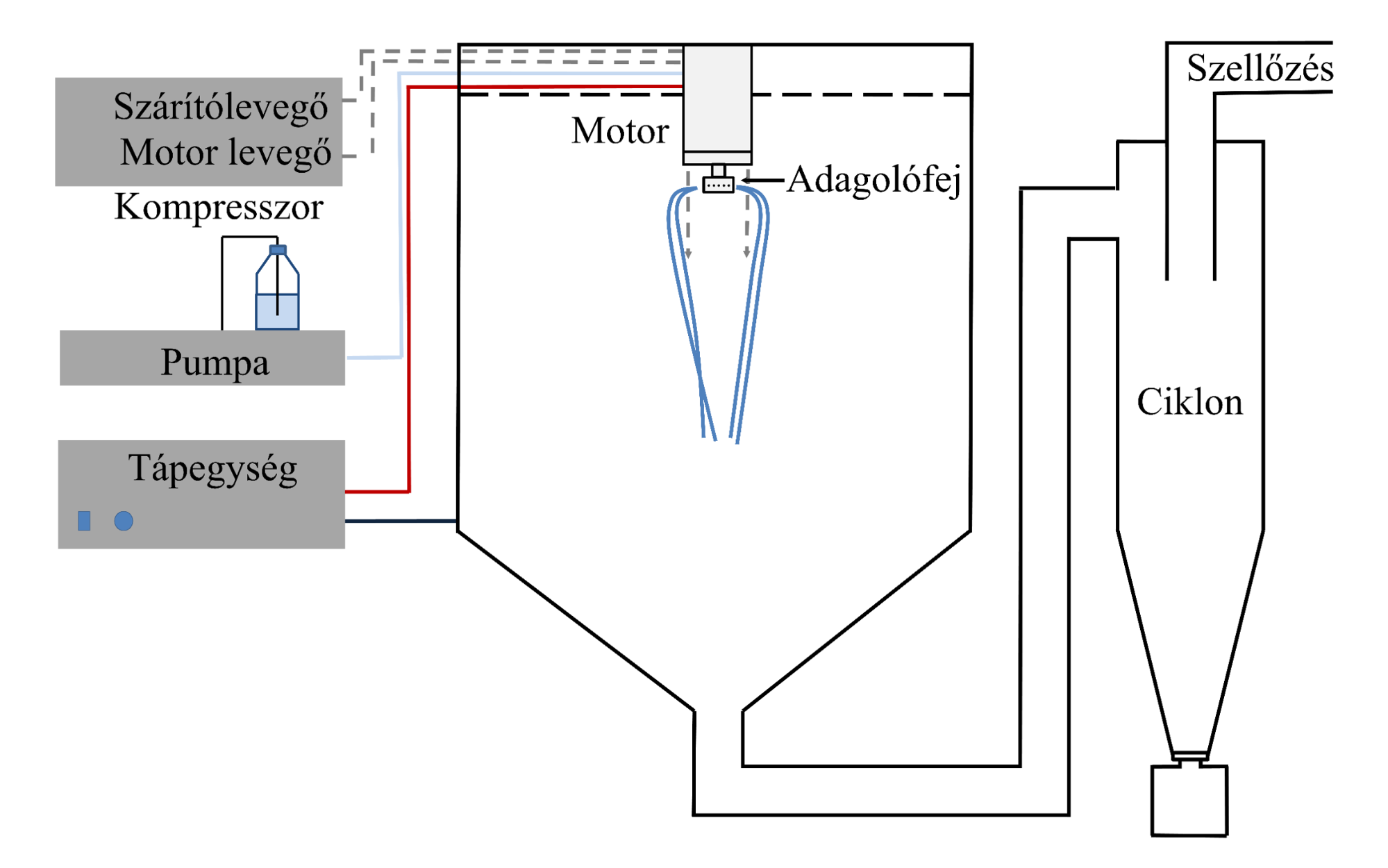

1. ábra: Nagy sebességű elektrosztatikus szálképző berendezés (sematikus ábra és fénykép)
A szálak feldolgozhatóságát őrlési kísérletekkel vizsgáltam. Ezt három különböző módszerrel végeztem: egy szita felhasználásával, egy kalapácsos malommal és egy oszcilláló őrlővel. Ezt követően az őrölt szálakat segédanyagokkal kevertem, majd tablettáztam. A biohatóanyag-tartalmú gyógyszerkészítmények hosszú távú stabilitásának biztosítása elengedhetetlen a gyógyszeripari alkalmazásukhoz, ezért fontos vizsgálni, hogy a kifejlesztett új formulációk alkalmasak-e a biohatóanyagok tárolási stabilitásának fenntartására. A mintákat zárt mintatartóban tároltam a hosszú távú stabilitásteszt (6-12 hónap) alatt.
A szálképzett anyagokban és az előállított tablettákban a Clostridium butyricum életképességét a telepképző egységek mérésével, a β-galaktozidáz enzimaktivitását pedig egy, az enzim által katalizált reakció nyomon követésével vizsgáltam.
A szálképzett anyagok és az előállított tabletták fizikokémiai karakterizálása során a következő analitikai technikákat használtam fel: pásztázó elektronmikroszkópia, termogravimetria, modulált differenciális pásztázó kalorimetria, por-röntgendiffrakció, Raman-spektrometrián alapuló kémiai térképezés és törési szilárdság mérése.
Eddigi eredmények
Sikeresen valósítottam meg enzim- és baktériumtartalmú szálak méretnövelt gyártását szobahőmérsékleten, nagy sebességű elektrosztatikus szálképzéssel. A legnagyobb elért termelékenység 270 g/óra volt, ami 300-szor nagyobb, mint ami a hagyományos szálképzési módszerekkel elérhető.

2. ábra: Biohatóanyag-tartalmú szálak nagy termelékenységű gyártása
Az előállított szálak gyártás után jellemzően rossz folyási tulajdonságokkal bírtak, és így a végső gyógyszerforma (ebben az esetben tabletta) kialakításához szükség volt a szálak őrlésére. A szálak jól őrölhetőek voltak másodlagos szárítás nélkül is. A pásztázó elektronmikroszkóppal készített képek megmutatták, hogy a szálak rövid fragmensekké törtek össze, de a szálas struktúrájukat megőrizték.


3. ábra: Biohatóanyag-tartalmú szálak pásztázó elektronmikroszkópos képe őrlés előtt és után
Az őrölt szálakat tablettázási segédanyagokkal bekeverve a kapott porok már megfelelő gördülékenységűek voltak, és így alkalmasak voltak direkt préseléses tablettázásra.



4. ábra: Őrölt biohatóanyag-tartalmú szálak automata tablettázása
Vizsgáltam a gyártási és feldolgozási lépések (szálképzés, őrlés, tablettázás) és a hosszú távú tárolás hatását az enzimre és a baktériumsejtek életképességére.
A β-galaktozidáz esetén nem figyeltem meg szignifikáns aktivitáscsökkenést egyik feldolgozási lépés után sem. Emellett az enzim stabil maradt a tablettákban 1 év tárolás után is mind 4 °C-on, mind szobahőmérsékleten.
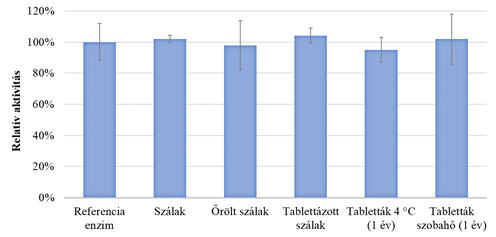
5. ábra: A β-galaktozidáz aktivitása a szálképzés, az őrlés, a tablettázás és a tabletták 1 éves tárolása után (tárolás 4 °C-on és szobahőmérsékleten)
A baktériumok életképessége kis mértékben csökkent a szálképzési oldatba keverés és a szálképzés után. Az életképesség-csökkenés mögött az állhat, hogy a vegetatív sejtek és spórák ozmotikus környezete hirtelen megváltozik az oldatba keveréskor, illetve szálképzés során ki vannak téve a nagyfeszültség és a pillanatszerű oldószer-elpárolgás hatásának. A baktériumok megőrizték a vajsavtermelő képességüket a szálakban, ami azt mutatja, hogy ez az új szilárd forma valódi terápiás potenciállal rendelkezik. Telepképző egységek mennyiségének mérésével bizonyítottam, hogy a feldolgozási lépések (őrlés, tablettázás) nem csökkentik szignifikánsan az életképes baktériumok számát. A tárolási teszt eredményeiről általánosságban elmondható, hogy az anaerob környezetben tárolt minták jobb túléléssel bírtak, mint az oxigén jelenlétében tárolt minták ugyanazon a tárolási hőmérsékleten, azonban az oxigén jelenlétében, szobahőmérsékleten tárolt minta még így is megfelelően sok élő sejtet tartalmazott ahhoz, hogy egy gyógyszer-készítményben alkalmazható legyen.
Összefoglalva, a nagy sebességű elektrosztatikus szálképzéssel megvalósítható kíméletes szárítás és az alkalmazott feldolgozható mátrixok lehetővé tették, hogy a vizsgált modell biohatóanyagokból könnyen adagolható orális végső gyógyszerformát állítsak elő a hatóanyag aktivitásának jelentős csökkenése nélkül.
Várható impakt, további kutatás
Munkám során bemutattam, hogy a nagy sebességű elektrosztatikus szálképzés egy ígéretes technológia biohatóanyagok kíméletes szárítására, mely képes a fagyasztva szárítás során tapasztalt hátrányok kiküszöbölésére. E munka jelentős részét a Janssen kutatóival együttműködésben valósítottam meg (Johnson & Johnson gyógyszeripari vállalata). Így az elért eredmények jelentős ipari érdeklődésre tartanak számot, és a hasznosításuk a közeljövőben megtörténhet.
A kutatás folytatásaként szálak aszeptikus előállítási lehetőségeit vizsgálom, mivel parenterális végső gyógyszerformák esetén a szilárd forma sterilitása kulcsfontosságú.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája (IF: impakt faktor, IC: független hivatkozások)
[1] P. Vass, B. Démuth, E. Hirsch, B. Nagy, S.K. Andersen, T. Vigh, G. Verreck, I. Csontos, Z.K. Nagy, G. Marosi, Drying technology strategies for colon-targeted oral delivery of biopharmaceuticals, Journal of Controlled Release, 296 (2019) 162–178.
IF: 7,877 IC: 18
[2] P. Vass, B. Démuth, A. Farkas, E. Hirsch, E. Szabó, B. Nagy, S.K. Andersen, T. Vigh, G. Verreck, I. Csontos, G. Marosi, Z.K. Nagy, Continuous alternative to freeze drying: Manufacturing of cyclodextrin-based reconstitution powder from aqueous solution using scaled-up electrospinning, Journal of Controlled Release, 298 (2019) 120–127.
IF: 7,877 IC: 15
[3] P. Vass, E. Szabó, A. Domokos, E. Hirsch, D. Galata, B. Farkas, B. Démuth, S.K. Andersen, T. Vigh, G. Verreck, G. Marosi, Z.K. Nagy, Scale‐up of electrospinning technology: Applications in the pharmaceutical industry, WIREs Nanomedicine and Nanobiotechnology, (2019) e1611.
IF: 6,140 IC: 7
[4] P. Vass, E. Hirsch, R. Kóczián, B. Démuth, A. Farkas, C. Fehér, E. Szabó, Á. Németh, S.K. Andersen, T. Vigh, G. Verreck, I. Csontos, G. Marosi, Z.K. Nagy, Scaled-up production and tableting of grindable electrospun fibers containing a protein-type drug, Pharmaceutics, 11 (2019) 329.
IF: 4,773 IC: 2
[5] P. Vass, Z.K. Nagy, R. Kóczián, C. Fehér, B. Démuth, E. Szabó, S.K. Andersen, T. Vigh, G. Verreck, I. Csontos, G. Marosi, E. Hirsch, Continuous drying of a protein-type drug using scaled-up fiber formation with HP-β-CD matrix resulting in a directly compressible powder for tableting, European Journal of Pharmaceutical Sciences, 141 (2020) 105089.
IF: 3,532 IC: 0
[6] P. Vass, E. Pantea, A. Domokos, E. Hirsch, Á. Németh, M. Molnár, Cs. Fehér, S.K. Andersen, T. Vigh, G. Verreck, I. Csontos, G. Marosi, Z.K. Nagy, Electrospun Solid Formulation of Anaerobic Gut Microbiome Bacteria, AAPS PharmSciTech, (2020).
IF: 2,401 IC: 0
[7] K. Kiss, P. Vass, A. Farkas, E. Hirsch, E. Szabó, G. Mező, Z.K. Nagy, G. Marosi, A solid doxycycline HP-β-CD formulation for reconstitution (i.v. bolus) prepared by scaled-up electrospinning, International Journal of Pharmaceutics, 586 (2020) 119539.
IF: 4,845 IC: 0
[8] E. Szabó, B. Démuth, D.L. Galata, P. Vass, E. Hirsch, I. Csontos, G. Marosi, Z.K. Nagy, Continuous formulation approaches of amorphous solid dispersions: Significance of powder flow properties and feeding performance, Pharmaceutics, 11 (2019) 654.
IF: 4,773 IC: 1
[9] E. Hirsch, P. Vass, B. Demuth, Z. Petho, E. Bitay, S.K. Andersen, T. Vigh, G. Verreck, K. Molnar, Z.K. Nagy, G. Marosi, Electrospinning scale-up and formulation development of PVA nanofibers aiming oral delivery of biopharmaceuticals, Express Polymer Letters, 13 (2019) 590–603.
IF: 2,875 IC: 4
[10] I. Wagner, Z.K. Nagy, P. Vass, C. Fehér, Z. Barta, T. Vigh, P.L. Sóti, A.H. Harasztos, H. Pataki, A. Balogh, G. Verreck, I.V. Assche, G. Marosi, Stable formulation of protein-type drug in electrospun polymeric fiber followed by tableting and scaling-up experiments, Polymers for Advanced Technologies, 26 (2015) 1461–1467.
IF: 1,823 IC: 5
Linkgyűjtemény
Hivatkozások listája
[1] G. Walsh, Biopharmaceutical benchmarks 2018, Nat. Biotechnol., 36 (2018) 1136–1145.
[2] A. Langford, B. Bhatnagar, R. Walters, S. Tchessalov, S. Ohtake, Drying technologies for biopharmaceutical applications: Recent developments and future direction, Drying Technol., (2017) 1–8.
[3] W. Wang, Lyophilization and development of solid protein pharmaceuticals, Int. J. Pharm., 203 (2000) 1–60.
[4] P. Mehta, R. Haj-Ahmad, M. Rasekh, M.S. Arshad, A. Smith, S.M. van der Merwe, X. Li, M.-W. Chang, Z. Ahmad, Pharmaceutical and biomaterial engineering via electrohydrodynamic atomization technologies, Drug Discov. Today, 22 (2017) 157–165.
[5] B. Démuth, A. Farkas, B. Szabó, A. Balogh, B. Nagy, E. Vágó, T. Vigh, A.P. Tinke, Z. Kazsu, Á. Demeter, J. Bertels, J. Mensch, A. Van Dijck, G. Verreck, I. Van Assche, G. Marosi, Z.K. Nagy, Development and tableting of directly compressible powder from electrospun nanofibrous amorphous solid dispersion, Adv. Powder Technol., 28 (2017) 1554–1563.
