|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME Vegyészmérnöki és Biomérnöki Kar, Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Pataki Hajnalka, Dr. Marosi György
Folyamatos kristályosítási technológiák fejlesztése egy folyamatos technológiával előállított szintéziselegy feldolgozására
A kutatási téma néhány soros bemutatása
Még soha nem volt ennyire sürgető a gyógyszerkészítmények fejlesztésének felgyorsítása, mint a jelenlegi globális helyzetben. Ezt az igényt folyamatos technológiákkal lehetne kielégíteni, melyek fejlesztése rövidebb és rugalmasabb, valamint méretnövelése egyszerűbb és agilisabb, mint a jelenleg elterjedten alkalmazott szakaszos üzemű eljárásoké. Felismerve ezeket az előnyöket, a gyógyszercégek és hatóság emberei a folyamatos technológiákra való átállást szorgalmazzák. Ennek hatására számos szintetikus és formulálási lépés került megvalósításra folyamatos üzemmódban; az ilyen technológiák közvetlen összekapcsolásával vagy összehasonlításával azonban csak néhány tanulmány foglalkozik [1]. Ennek megfelelően munkám során olyan folyamatos kristályosítási eljárások fejlesztésén dolgoztam, melyek alkalmasak egy folyamatos szintézissel előállított reakcióelegy közvetlen feldolgozására, és akár további formulációs lépésekkel is összekapcsolhatók. Emellett részletesen jellemeztem a termékek minőségét, és ezen keresztül a összehasonlítottam a fejlesztett módszereket, ezzel segítve a gyógyszerkutatókat a technológiák közötti választásban.
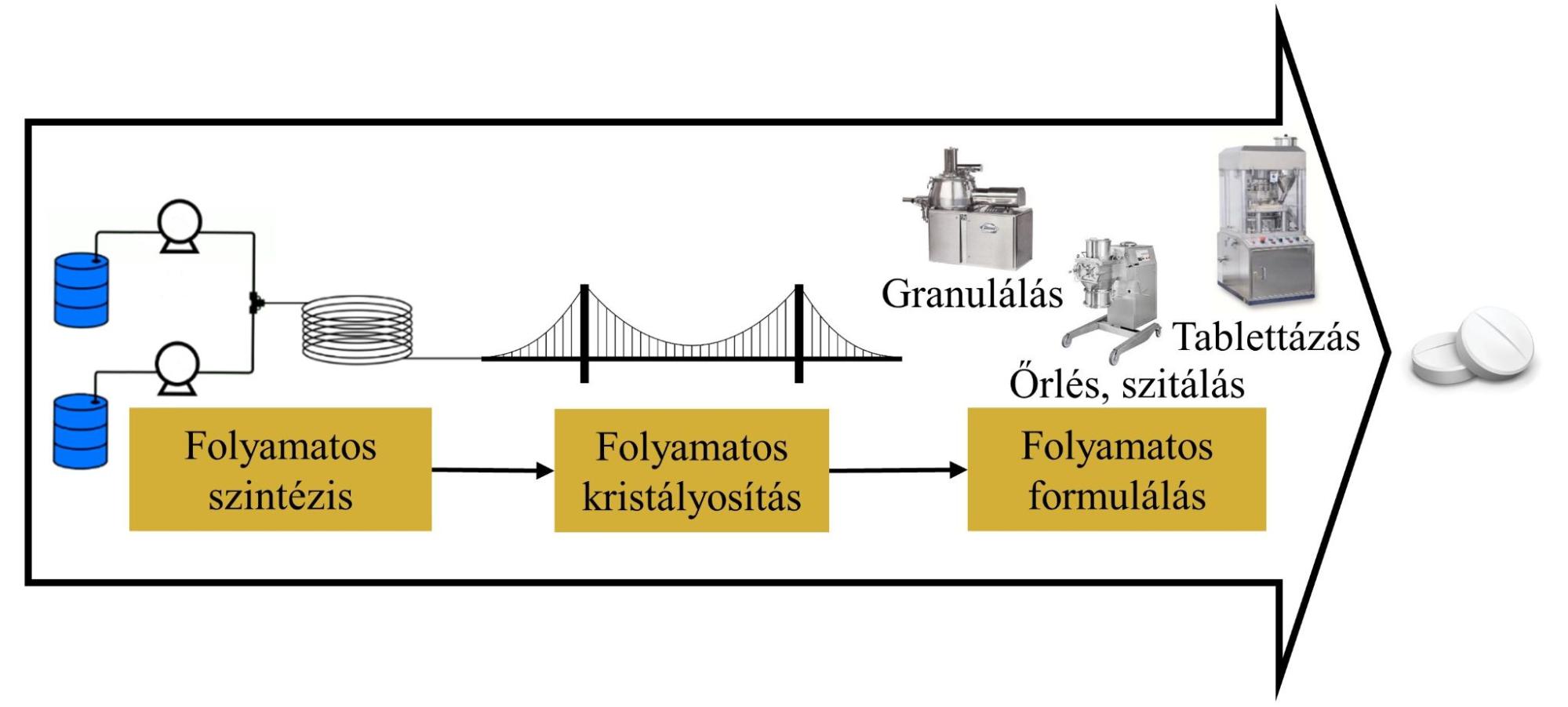
- ábra: Folyamatos kristályosítás: a kapocs a folyamatos szintézis és formulálás között
A kutatóhely rövid bemutatása
A FirePharma kutatócsoportban az egyik célkitűzésünk a gyógyszeripari innováció támogatása különféle újszerű folyamatos gyógyszertechnológiák fejlesztésével, valamint a legmodernebb analitikai és technológiai megoldásokat alkalmazva az ehhez kapcsolódó valós idejű minőség monitorozó és szabályzó rendszerek kidolgozásával. Az elmúlt évek ipari együttműködései bizonyítják, hogy mostanra kiváló partneri kapcsolatot ápolunk számos meghatározó hazai és nemzetközi gyógyszercéggel, és együttműködünk akadémiai kutatócsoportokkal.
A kutatás történetének, tágabb kontextusának bemutatása
A kristályosítás, mint hatóanyaggyártásban a legelterjedtebben alkalmazott elválasztási és tisztítási módszer, kritikus technológia, mivel a kristályosítási folyamat paramétereivel befolyásolható a termék mennyisége és morfológiai tulajdonságai (kristályszerkezet, kristályalak, szemcseméret és szemcseméret-eloszlás). Ennek következtében a kristályosítással szabályozhatók a termék technológiai (folyóképesség, tömöríthetőség) és biológiai (biohasznosulás) tulajdonságai. Gyógyszeripari jelentőségét az is szemlélteti, hogy a kismolekulás gyógyszerek több mint 90%-a kristályos formában kerül forgalomba, míg a gyógyszerkészítmények előállításának több mint 80%-a legalább egy kristályosítási lépést tartalmaz [2,3]. Az innovatív folyamatos eljárások alkalmazásával a teljes gyártási művelet biztonságosabbá és gazdaságosabbá tehető. Ennek megfelelően kutatócsoportunkban folyamatos, end-to-end gyártási alternatívák kidolgozásán dolgozunk, melynek lényeges része a különböző folyamatos kristályosítási technológiák fejlesztése, vizsgálata és megértése [4,5].
A publikált folyamatos kristályosítási eljárások többsége tiszta, nagy koncentrációjú oldatból indul ki [6,7]. Ezzel szemben egy szennyező melléktermékeket tartalmazó, állandó összetételű reakcióelegy feldolgozása kihívást jelent, mivel a kristályosítás során kevesebb paraméter változtatható; ezért csak néhány tanulmány foglalkozik ezzel a kérdéssel.
A kutatás célja, a megválaszolandó kérdések
Kutatásom célja folyamatos kristályosítási módszerek kidolgozása az acetilszalicilsav (ASA, az Aszpirin hatóanyaga) folyamatos szintézissel előállított reakcióelegyéből történő direkt feldolgozására. Ennek keretében olyan eljárásokat fejlesztek, amelyek az ASA modellgyógyszer end-to-end folyamatos gyártásába illeszthetők, tiszta, homogén kristályos termékeket biztosítva a további gyógyszerformulálási lépésekhez. Ebből a célból négy különböző, saját építésű folyamatos kristályosító rendszert alkalmaztam és vizsgáltam: (I.) folyamatos túlfolyós tartálykristályosítót (mixed suspension mixed product removal, MSMPR), (II.) triplasugarú ütköztetéses (triple impinging jet, TIJ) keverőelemet, amely egy túlfolyós tartálykristályosítóhoz kapcsolódik (TIJ-MSMPR), (III.) ultrahangozott csőkristályosító (plug flow crystallizer, PFC) és (IV.) összekapcsolt ultrahangozott PFC és túlfolyós tartálykristályosító rendszer (PF-MSMPR) folyamatos segédanyagos kristályosítás végrehajtásához. Az összehasonlíthatóság érdekében a felsorolt kristályosítási technológiákat hasonló beállítású kísérletsorozatokkal vizsgáltam.
Módszerek
A feldolgozott flow reakcióelegy ASA hatóanyagot, 5% szalicilsav (SA) szennyezőt és többféle oldószert, például etil-acetátot, ecetsavat vagy etanolt tartalmazott.
Négy folyamatos kristályosító rendszert alkalmaztam az ASA-oldat hűtéses–kicsapásos kristályosítására. A megfelelő hozam érdekében az oldat térfogatához képest többszörös (2-4-6x) mennyiségű kicsapószert használtam. (I.) Az MSMPR kristályosítóból egy túlfolyón keresztül történt az előállított szuszpenzió folyamatos eltávolítása, a termék mechanikai degradációjának elkerülése érdekében. A túlfolyócső közelébe egy belső függőleges lemezt (bukógát) helyeztem, amivel megakadályozható a betáplált oldat azonnali kimosódása, és elősegíthető a termék reprezentatív kinyerése. (II.) A triplasugarú ütköztetéses keverőt úgy alakítottam ki, hogy hatékony keverést biztosítson még akkor is, ha az oldat és kicsapószer folyadékáramok aránya nem egyenlő. A keverőben két egyenlő kicsapószeráram ütközött egy ASA-oldatárammal. A megfelelő kristályosítási idő biztosítása és a nagyobb termelékenység érdekében a TIJ keverőt egy túlfolyós MSMPR kristályosítóval kombináltam.


2. ábra: A tartálykristályosító és a TIJ-MSMPR rendszer sematikus ábrája és fotója
(III.) A csőkristályosítót koaxiális keverővel láttam el, amely hatékony keverést biztosít erősen túltelített, instabil rendszerekben, ahol a hagyományos keverőelemek gyorsan eltömődtek. Emellett ultrahangos besugárzással segítettem elő a homogén kristályképződést, és ezzel megakadályoztam kristályosító csövek eltömődését. (IV.) Az összekapcsolt PF-MSMPR rendszerben folyamatos segédanyagos kristályosítást hajtottam végre a termék morfológiájának módosítása érdekében, javítva egy kis méretű termék technológiai tulajdonságait (folyóképesség). Ehhez az előbb bemutatott ultrahangozott csőkristályosítóban (PFC) előállított szuszpenziót egy túlfolyós MSMPR kristályosítóba vezettem. Ezzel párhuzamosan 1, 7,5 vagy 14% mennyiségű polivinil-pirrolidon K30 (PVP-K30) segédanyagot tápláltam a tartálykristályosítóba.
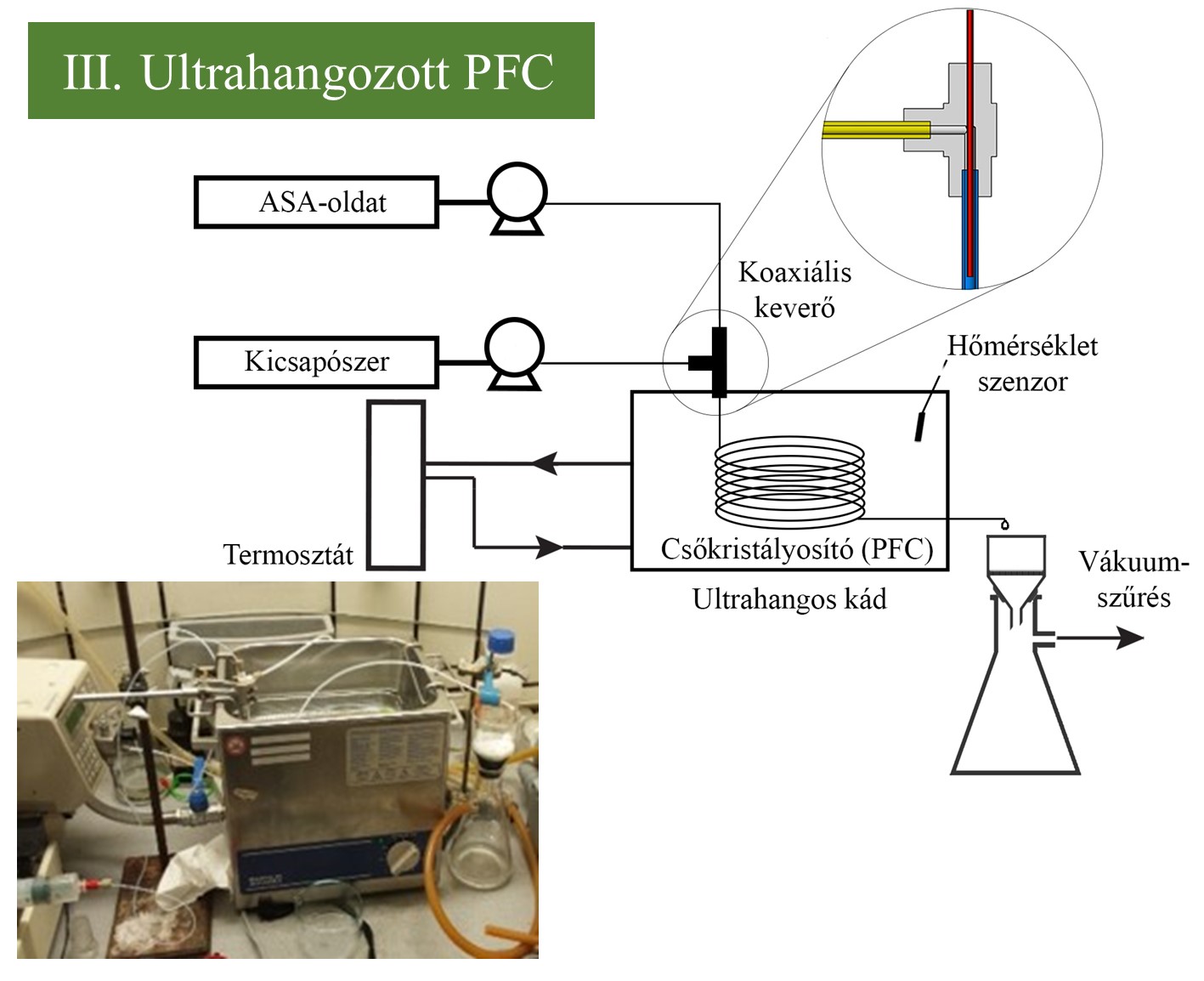

3. ábra: A csőkristályosító és PF-MSMPR rendszer sematikus ábrája és fotója
Az ASA-oldatot és az n-heptán kicsapószert pumpákkal tápláltam a kristályosítókba, majd a keletkezett szuszpenziót közvetlenül üvegszűrőre vezettem és szűrtem. A mintákat szobahőmérsékleten tömegállandóságig szárítottam.
A folyamatos kísérletek legalább 15 tartózkodási ideig (akár 16 óráig) tartottak a rendszerek hosszú távú működőképességének tesztelésére, amely alatt a terméket többször is mintáztam. A technológiákkal 22-os vagy 23-os kísérletterveket hajtottam végre a kristályosodási paraméterek tisztaságra, kristályalakra, szemcseméretre, szemcseméret-eloszlásra, gördülékenységre, kioldódási profilra, termelésre és termelékenységre gyakorolt hatásának feltérképezésére.
A kristályos termékek jellemzésére a következő analitikai technikákat alkalmaztam: HPLC, inverz mikroszkóp, szemcseméret-eloszlás mérése lézerdiffrakciós módszerrel, Raman-spektroszkópián alapuló kémiai térképezés, folyóképesség-analízis és kioldódási vizsgálat.
Eddigi eredmények
A kifejlesztett folyamatos kristályosítási technológiákkal sikerült a kapott szintéziselegyből nagy termeléssel és jó tisztasággal ASA-t előállítanom. Megállapítottam, hogy az MSMPR és a PF-MSMPR termékek szennyezőanyag-tartalma a legalacsonyabb (átlagosan 0,3–0,4%), míg a PFC termékekben valamivel magasabb (átlagosan 0,7%). A PF-MSMPR rendszerben előállított termék PVP-K30 tartalma maximum 7,7% volt az alkalmazott polimer mennyiségétől függően.
A hőmérséklet és a kicsapószer/ASA-oldat (AS/ASA) arány jelentősen befolyásolta a kihozatalt. A hasonló folyamatparaméterek mellett üzemeltetett TIJ-MSMPR, PFC és PF-MSMPR rendszerek hasonlóan teljesítettek termelés (63–85%) és termelékenység (folyamatkörülményektől függően 3,2–28,1 g/h) tekintetében.

4. ábra: A technológiák összehasonlítása szennyezőanyag-tartalom és termelés alapján
Az állandósult állapot eléréséhez szükséges időt illetően a technológiák jelentősen eltértek egymástól. Az MSMPR kristályosító esetén a felfutási szakasz órákig tartott (1,5–6 h), míg a PFC vagy PF-MSMPR rendszereknél a termékminőség az első mintavételtől kezdve változatlan maradt (PFC: 30–90 s, PF-MSMPR: 8–25 perc szükséges).
Az MSMPR kristályosító terméke kevésbé homogén, nagy (~550 μm) izometrikus kristályokból és agglomerátumokból állt. Az MSMPR termék bár lassabb kioldódási sebességgel jellemezhető (7. ábra) ugyanakkor kedvező folyóképességű, így potenciálisan tovább feldolgozható akár direkt tablettázással. A TIJ-MSMPR rendszerben a triplasugarú ütköztetéses keverő segítségével kisebb oszlopos kristályokat (<180 μm) tartalmazó homogén terméket állítottam elő. A csőkristályosítóban homogén, kisméretű (<50 μm) tűs kristályok keletkeztek. Ez utóbbi termék rosszabb folyási tulajdonságokkal rendelkezik ugyanakkor kioldódása gyorsabb, mint a korábbi technológiák esetén, így kedvező eljárás lehet például rossz kioldódású hatóanyagok esetén.
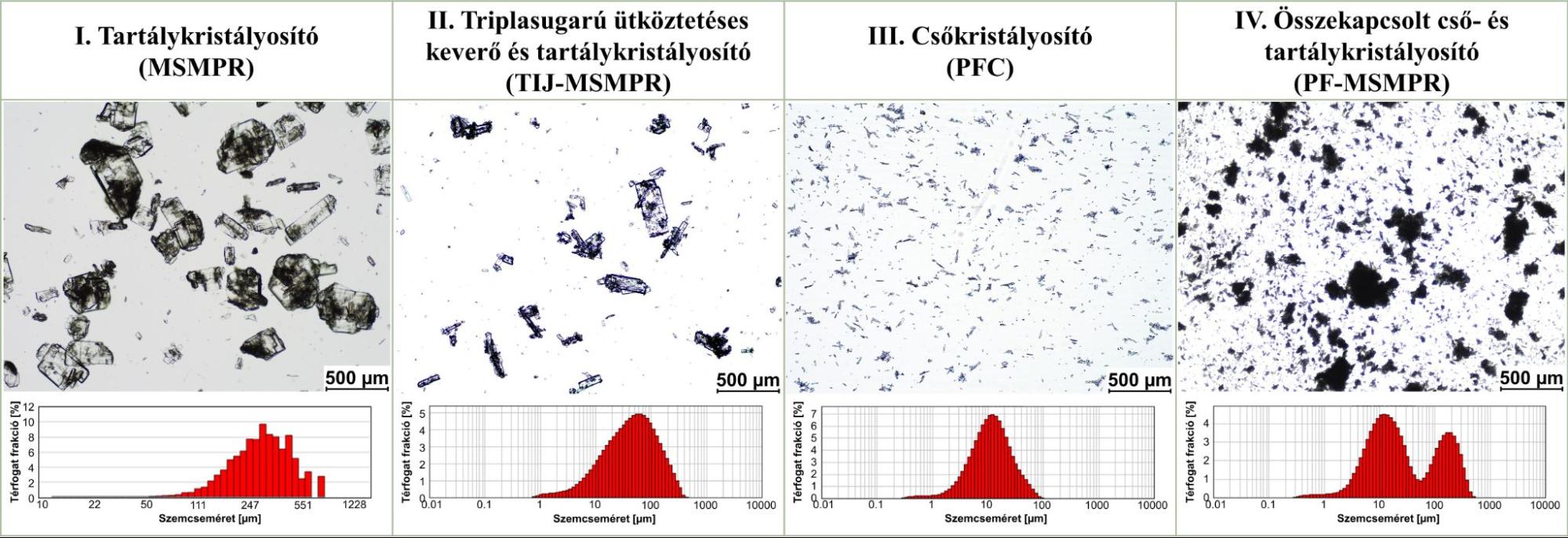
5. ábra: A termékek mikroszkópos képei és szemcseméret-eloszlás görbéi (T: 25°C)
Az összekapcsolt PF-MSMPR rendszerben megvalósított folyamatos segédanyagos kristályosítás lehetővé teszi a PFC és MSMPR rendszerek előnyeinek kombinálását. Nagyobb mennyiségű (7,5–14%) PVP-K30 elősegíti a csőkristályosítóban előállított primer részecskék összetapadását, ami akár 450 μm méretű aggregátumokat is eredményezhet. A morfológiamódosításnak köszönhetően több kategóriával javult a termék gördülékenysége, így az aggregátumokat alkotó „nagyon rossz” besorolású szemcsék folyóképessége a „megfelelő” osztályba került.


6. ábra: Rossz és kedvező folyási tulajdonságú termékek
Ahogy az a 7. ábrán látható, az aggregátumokat felépítő PFC termékre jellemző kedvező oldódási tulajdonság ugyanakkor megmaradt.

7. ábra: Az MSMPR, PFC és PF-MSMPR termékek kioldódásgörbéje
Várható impakt, további kutatás
Munkám során különféle, a folyamatos szintézis és formulálási eljárások összekapcsolására alkalmas folyamatos kristályosítási technológiákat fejlesztettem. Továbbá részletesen jellemeztem a termékminőség és -mennyiség folyamatparaméter-függését az egyes technikák esetén, feltárva a módszerek termékmorfológiai módosítási potenciálját. Ez a tanulmány tehát útmutatást ad a gyógyszerkutatóknak ezen innovatív módszerek közötti választásban a kívánt technológiai és termék jellemzők alapján. A kutatás eredménye jól szemlélteti, hogy milyen változatos stratégiákkal (kristályosítási folyamatparaméterek, alkalmazott berendezés karakterisztikája, keverés módja, adalékok alkalmazása) módosítható a termék minősége, ezáltal egyaránt hasznos eszköz lehet a kristálymérnökök számára.
A kutatás folytatásaként célom a kifejlesztett technológiák tesztelése más szintéziselegyek (pl. flibanszerin) feldolgozására, valamint a technológiák összekapcsolása további folyamatos üzemű feldolgozó lépésekkel (pl. szűrés, szárítás).
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája (IF: impakt faktor, IC: független hivatkozások)
[1] K. Tacsi, M. Gyürkés, I. Csontos, A. Farkas, E. Borbás, Z.K. Nagy, G. Marosi, H. Pataki, Polymorphic Concentration Control for Crystallization Using Raman and Attenuated Total Reflectance Ultraviolet-Visible Spectroscopy, Crystal Growth & Design, 2020, 20, 73–86.
IF: 4,076
[2] K. Tacsi, H. Pataki, A. Domokos, B. Nagy, I. Csontos, I. Markovits, F. Farkas, Z.K. Nagy, G. Marosi, Direct processing of a flow reaction mixture using continuous mixed suspension mixed product removal crystallizer, Cryst. Growth Des. 2020, 20, 4433–4442
IF: 4,076
[3] K. Tacsi, A. Joo, E. Pusztai, A. Domokos, Z.K. Nagy, G. Marosi, H. Pataki, Development of a triple impinging jet mixer for continuous antisolvent crystallization of acetylsalicylic acid reaction mixture, Chem. Eng. Process. Process Intensif. 2021, 165, 108446
IF: 4,237
[4] K. Tacsi, G. Stoffán, E. Pusztai, B. Nagy, A. Domokos, B. Szilágyi, Z.K. Nagy, G. Marosi, H. Pataki, Implementation of sonicated continuous plug flow crystallization technology for processing of acetylsalicylic acid reaction mixture, Powder Technology, 2022, 400, 117255
IF: 5,134
[5] A. Domokos, B. Nagy, M. Gyürkés, A. Farkas, K. Tacsi, H. Pataki, Y.C. Liu, A. Balogh, P. Firth, B. Szilágyi, G. Marosi, Z.K. Nagy, Z. K. Nagy, End-to-end continuous manufacturing of conventional compressed tablets: From flow synthesis to tableting through integrated crystallization and filtration, Int. J. Pharma., 2020, 581, 119297
IF: 5,875
[6] B. Nagy, B. Szilágyi, A. Domokos, K. Tacsi, H. Pataki, G. Marosi, Z. K. Nagy, Z.K. Nagy, Modeling of pharmaceutical filtration and continuous integrated crystallization-filtration processes, Chemical Engineering Journal, 2020, 413, 127566
IF: 13,273
[7] B. Nagy, B. Szilágyi, A. Domokos, B. Vészi, K. Tacsi, Z. Rapi, H. Pataki, G. Marosi, Z.K. Nagy, Z.K. Nagy, Dynamic flowsheet model development and digital design of continuous pharmaceutical manufacturing with dissolution modeling of the final product, Chem. Eng. J. 2021, 129947
IF: 13,273
[8] A. Domokos, L. Madarász, G. Stoffán, K. Tacsi, D. Galata, K. Csorba, P. Vass, Z.K. Nagy, H. Pataki. Real-Time Monitoring of Continuous Pharmaceutical Mixed Suspension Mixed Product Removal Crystallization Using Image Analysis, Organic Process Research & Development, 2022, 26, 1, 149-158
IF: 3,317
Linkgyűjtemény.
Hivatkozások listája.
[1] Mascia, S.; Heider, P. L.; Zhang, H.; Lakerveld, R.; Benyahia, B.; Barton, P. I.; Braatz, R. D.; Cooney, C. L.; Evans, J. M. B.; Jamison, T. F.; Jensen, K. F.; Myerson, A. S.; Trout, B. L. End-to-End Continuous Manufacturing of Pharmaceuticals: Integrated Synthesis, Purification, and Final Dosage Formation. Angew. Chem., Int. Ed. 2013, 52, 12359− 12363.
[2] Chen, J.; Sarma, B.; Evans, J.M.B.; Myerson, A.S. Pharmaceutical Crystallization. Cryst. Growth Des. 2011, 11, 887–895.
[3] M. Lin, Experimental and Numerical Study of Polymorphism in Crystallization Processes, 2020.
[4] Balogh, A.; Domokos, A.; Farkas, B.; Farkas, A.; Rapi, Z.; Kiss, D.; Nyiri, Z.; Eke, Z.; Szarka, G.; Örkényi, R.; Mátravölgyi, B.; Faigl, F.; Marosi, G.; Nagy, Z. K. Continuous End-to-End Production of Solid Drug Dosage Forms: Coupling Flow Synthesis and Formulation by Electrospinning. Chem. Eng. J. 2018, 350, 290–299.
[5] Domokos, A.; Nagy, B.; Gyürkés, M.; Farkas, A.; Tacsi, K.; Pataki, H.; Liu, Y. C.; Balogh, A.; Firth, P.; Szilágyi, B.; Marosi, G.; Nagy, Z. K.; Nagy, Z. K. End-to-End Continuous Manufacturing of Conventional Compressed Tablets: From Flow Synthesis to Tableting through Integrated Crystallization and Filtration. Int. J. Pharm. 2020, 581, 119297.
[6] Lührmann, M.-C.; Timmermann, J.; Schembecker, G.; Wohlgemuth, K. Enhanced Product Quality Control through Separation of Crystallization Phenomena in a Four-Stage MSMPR Cascade Enhanced Product Quality Control through Separation of Crystallization Phenomena in a Four-Stage MSMPR Cascade. Cryst. Growth Des. 2018, 18, 7323−7334
[7] Pal, S.; Madane, K.; Kulkarni, A. A. Antisolvent Based Precipitation: Batch, Capillary Flow Reactor, and Impinging Jet Reactor. Chem. Eng. J. 2019, 369, 1161−1171
