 |
BMe Kutatói pályázat |

|
BME Oláh György Doktori Iskola
BME VBK, Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Poppe László
Enzimek fejlesztése, tisztítása és újszerű alkalmazása kémiai szintézisekben
A kutatási téma néhány soros bemutatása
A klasszikus szerves kémiai reakciók megvalósításának modern alternatívája lehet a biokatalízis, mely során élőlények (jellemzően mikroorganizmusok) és enzimek segítségével állíthatunk elő szerves anyagokat. Biológiai rendszerek felhasználásával többlépéses szintézisutakat rövidíthetünk le sokszor az eredetinél enyhébb reakciókörülmények (hőmérséklet, nyomás, reakcióidő) között.
Kutatómunkám során a biokatalízis újszerű megvalósításának lehetőségeit vizsgálom annak érdekében, hogy az alkalmazott biokatalizátorral végrehajtott szerves reakciók produktívabbak és szelektívebbek (a lehetséges melléktermékekből minimális képződjön) legyenek.
A kutatóhely rövid bemutatása
A BME Szerves Kémiai és Technológia Tanszékén működő Bioorganikus kutatócsoport célja enzimek alkalmazási lehetőségeinek vizsgálata, kiterjesztése a szerves kémiai szintézisekben. Az alapkutatásokon felül a projektek léptéknövelt megvalósíthatóságának lehetőségét akadémiai (Enzimológiai Intézet, KKKI, BBTE) és ipari partnerekkel (ThalesNano, Fermentia, BIBUS) együttműködve dolgozzuk ki, a legkorszerűbb technológiákat alkalmazva és a legszigorúbb környezetvédelmi szabályok figyelembevételével.
A kutatás történetének, tágabb kontextusának bemutatása
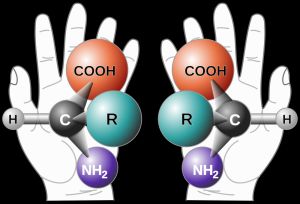
Napjainkban a szerves kémia egyik legnagyobb kihívása a biológiailag aktív vegyületek gazdaságos szintézise. A gyógyszeripar mellett a növényvédőszer-gyártásban, a műanyag-, a kozmetikai-, és az élelmiszeriparban is rendkívül fontos az enantiomerek nagytisztaságú előállítása. Az enantiomerek olyan azonos összegképletű, de eltérő konfigurációjú, egymással tükörképi viszonyban álló molekulapárok, melyek legtöbb fizikai, kémiai tulajdonságai megegyeznek, ám biológiai hatásukban jelentős különbség mutatkozhat.
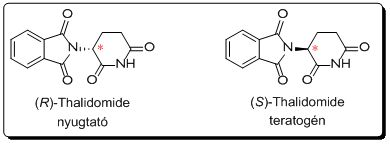
A felesleges enantiomer jelenléte jelentős problémákat okozhat. Egyik leghírhedtebb példa erre a Contergan-botrány néven elhíresült eset, amikor az (R)-Thalidomide hatóanyagot – mely nyugtató, altató hatású – nem választották el enantiomerpárjától, az (S)-Thalidomide-tól, mely teratogénnek bizonyult. A Contergan 1957 és 1961 között volt forgalomban, ezalatt körülbelül 12000 gyerek született halva vagy csonka végtagokkal.
Az enzimek fehérjék, amelyek királis aminosavakból épülnek fel, így egy kémiai reakcióban különbséget tudnak tenni egyazon molekula enantiomerjei között: azok közül csak az egyiket alakítják át, így lehetőséget teremt a számunkra hasznos és a “szennyező” enantiomer elválasztására. Biokatalízist és biotranszformációkat már hasznosítanak természetes és nem-természetes aminosavak, vitaminok és egyéb élelmiszer adalékok, antibiotikumok, rákellenes és vírusellenes szerek és egyéb gyógyszerek előállítása során.
Az enzimek a mai kor követelményeinek megfelelően környezetbarát katalizátorok, azonban az újabb és újabb célvegyületek előállításával kapcsolatos környezetvédelmi és minőségi követelmények szigorodása újabb és még hatékonyabb biokatalizátorok illetve biotranszformációk kidolgozását igénylik.
A kutatás célja, a megválaszolandó kérdések.
Majdnem minden szerves kémiai reakciónak létezik enzimekkel megvalósítható alternatívája, azonban az enzimek előállítása, tisztítása sokszor körülményes, amely megnöveli a felhasználásuk költségeit. A kutatás célja enzimek előállítása, tisztítása, stabilitásának növelése és szerves szintézisekben való újszerű felhasználása ipari megvalósíthatósági követelmények figyelembevételével.
AZ enzimek előállítását baktériumok és fonalas gombák fermentációjával végezzük, célul tűzve ki az enzim termeléséhez szükséges optimális paraméterek meghatározását.
Az előállított enzimek fermentációs elegyekből történő kinyerése és tisztítása általában a technológiák egyik legköltségigényesebb lépése. Célunk olyan szilárd enzimhordozók kifejlesztése, melyekkel közvetlenül képesek leszünk szelektíven elválasztani és kinyerni csak a számunkra hasznos enzimet a fermentációkból
A tisztított enzimek alkalmazási lehetőségeit korlátozza, hogy tárolhatósági idejük hűtött körülmények között is alacsony, érzékenyek a környezeti hatásokra, melyek aktivitásuk csökkenését, vagy teljes elveszítését jelenthetik. Különböző, újszerű enzimrögzítési technikákkal célunk növelni enzimek stabilitását, hőtűrőképességét, mechanikai tulajdonságait, aktivitását és szelektivitását annak érdekében, hogy szélesebb körben felhasználhatók legyenek különböző nagytisztaságú szerves vegyületek hatékony előállítására.
Az enzimek fehérje-természetüknél fogva vizes közegben, szűk pH- és hőmérséklet-tartományban működnek megfelelően. A szerves kémai szintézisek (pl. gyógyszer- vagy növényvédőszer-gyártás) sokszor megkövetelik szerves oldószeres vagy oldószermentes közegek használatát, általában enzimek számára extrém körülmények (túl magas vagy alacsony hőmérséklet vagy nyomás) között. Kutatásunk során célunk enzimes rendszerek működési tartományainak kiszélesítése újszerű felhasználási módokkal (pl. átfolyásos bioreaktorok használatával).
Módszerek
A vegyületek előállítását modern preparatív szerves kémiai módszerekkel végeztük, tisztaságukat vékonyréteg-kromatográfiás (VRK), mágneses magrezonanciás (NMR) és infravörös spektroszkópiás (IR) mérésekkel határoztuk meg.
Az enzimekkel végrehajtott előzetes szűrővizsgálatokat (screen) szakaszos üzemben, termosztált körülmények között, rázógépeken valósítottuk meg. Az egyszerre akár 100 reakcióelegy befogadására alkalmas, termosztálható készülékek segítségével a nagy mintaszámú kísérlet rendszerek kivitelezése egyszerűbbé tehető, a homogén keveredés és hőmérséklet eloszlás mellett a reakciók pontosan azonos körülmények között játszódnak le.
A folyamatos üzemű, átfolyásos bioreaktorokban végrehajtott kísérleteket ThalesNano X-CubeTM készüléken, illetve a kutatócsoport által fejlesztett termosztálható, 20 bioreaktor egyidejű és azonos körülmények között végrehajtható tesztelésére fejlesztett tömbtermosztát-alapú készülékkel végeztük. Ezekkel a reaktorokkal széles tartományban megvalósítható a hőmérséklet, a nyomás és az áramlási sebesség pontos szabályzása (-10-150°C; 0-150 bar; 0,1-3,0 ml/perc). Nyomás- és hőálló rozsdamentes oszlopokba töltetként a vizsgálni kívánt enzimkészítményt helyeztük, egy reakcióedényből az átalakítandó szubsztrát-molekulá(k) és a reagens(ek) oldatát egy pumpa segítségével átvezettük a biokatalizátorral töltött oszlopo(ko)n, mindeközben a paraméterek változtatásával meghatároztuk az adott reakció hőmérséklet-, áramlási sebesség- és nyomásfüggését. Így egy könnyen általánosítható eljárást kaptunk eredményül, mely a szubsztrátok és reakciók széles skáláján alkalmazható, és segítségével az enzimkatalizált reakciók működésének, mechanizmusának mélyebb értelmezésére is lehetőségünk nyílik.

A bioreaktorok katalizátor-tölteteként különböző, felületmódosított szilikagél-alapú hordozók felületére rögzített és szintén szilika-alapú polimer mátrixba zárt (szol-gél) enzimeket használtunk. A szilikagélek felületmódosítását szobahőmérsékleten, rázógépeken végeztük. A módosítani kívánt szilikagélt lúgtartalmú vizes metanolban szuszpendáltattuk majd különböző organoszilánokkal (szilícium-szén kötést tartalmazó vegyületek) vagy azok keverékével módosítottuk a felületet. Az így nyert szilárd hordozók kedvező mechanikai tulajdonságokkal rendelkeztek, és eltérő mértékűen hidrofób felületüknek köszönhetően különbözőképpen képesek megkötni az általunk vizsgált enzimeket. A szol-gél polimerbe zárás során különböző organoszilánokból kiindulva több lépésen keresztül térhálós polimereket alakítunk ki, mely az enzimet körbezárja, így védve azt a környezetei, fizikai, kémia és mechanikai hatásoktól.
A reakciók nyomon követéséhez és az enantiomer-összetételek meghatározásához királis állófázist tartalmazó gázkromatográfiás (GC) és nagy teljesítményű folyadékkromatográfiás (HPLC) analitikákat dolgoztunk ki. A technikák lényege, hogy egy álló (szilárd) fázisú tölteten egy mozgó fázissal (gáz vagy folyadék) keresztülhajtva egy keveréket, a komponensek különböző sebességgel haladnak át, így időben elkülönülve szétválaszthatók. Amennyiben az állófázis enantiomerek megkülönböztetésére alkalmas (királis) töltetet tartalmaz, akkor nem csak különböző kémiai anyagokat, hanem egyazon molekula enantiomerjeit is szét lehet választani, ezzel meghatározva a tisztaságukat.
Eddigi eredmények
Az említett enzim-tulajdonságok (tisztíthatóság, hő- és mechanikai stabilitás) hátrányainak kiküszöbölésére jelenthet megoldást enzimek specifikus rögzítése szilárd hordozóhoz, azonban az irodalomban általánosan használt szerves polimer hordozók (akril, sztirol, divinilbenzol vagy poliszacharidok) folyadékok hatására megduzzadhatnak, ezáltal korlátozva átáramlásos reaktorban történő használatukat.
A szilikagél sok tekintetben alkalmas enzimek tisztítására és rögzítésére, hiszen porózus szerkezetű, nagy fajlagos felületű és 400 bar nyomásnak is ellenáll. Ára kellően alacsony az ipari használathoz, és biokompatibilitásának köszönhetően alkalmas biomedicinális készítmények fejlesztésére. A szilikagél felszínének fizikai-kémai karaktere jelentősen befolyásolhatja a hozzá köthető enzim mennyiségét és aktivitását, hiszen a felületre történő adszorpció során hidrofób kölcsönhatás jön létre a felület és az enzim kötőhelye között úgy, hogy az enzim olyan konformációt vesz fel, mellyel alkalmas katalitikus feladatai hatékony ellátására.
Szilikagél felszínének módosításával hidrofobicitása, reaktivitása és specifikussága finomhangolható. Megvalósítottuk számos különböző szemcse- és pórusméretű szilikagél felületének funkcionalizálását több, mint 30 féle különböző reagenssel és azok keverékével. Az így nyert hordozók alkalmasnak bizonyultak fermentációval Pseudozyma aphidis fonalas gombából előállított enzimek kinyerésére nyers elegyekből [A] és enzimkeverékek (Candida antarctica A és B lipáz) elválasztására [B]. A módosított hordozók további átalakításokkal képesek voltak fémionokat komplexálni, így affinitáskromatográfiás fehérjetisztításra is (His6-jelölt dUTPáz enzim) [K] felhasználhatók. Az ilyen jellegű hordozók specifikusan képesek megkötni a megfelelően jelölt (His-tag) fehérjéket. A kereskedelemben kapható általános affinitáskromatográfiás hordozókkal szemben az általunk előállított anyagok tárolása egyszerűbb (nincs szükség folyadék alatti, hűtött tárolásra) és a toxikus, rákkeltő nikkel helyett a sokkal kevésbé mérgező és csekély ökológiai hatásokkal rendelkező lantanidákkal is kiválóan működnek.
A tisztítás során nyert szilikagél-alapú hordozó felületén fizikailag kötött enzimek, akár közvetlenül is hatékonyan felhasználhatók szerves szintézisekben. Vizes közegben azonban az enzim leválhat a hordozó felületéről. Ennek kiküszöbölésére alkalmas a szol-gél enzimrögzítés, mely során stabilabb, hőre kevésbé érzékenyebb biokatalizátorokat állíthatunk elő. Egyszerű modellvegyületek átalakításaiban igazoltuk, hogy a polimer mátrix alkotóinak változtatásával enzimre és reakcióra optimalizálható mátrixot hozhatunk létre, így egy „felhasználás-specifikus” készítménnyel növelhetjük a reakciók produktivitását és szelektivitását [C]. Bebizonyítottuk, hogy rögzítés során a mátrix alkotóihoz adott, az enzim természetes szubsztrátjával rokon szerkezetű anyag növeli az enzimek biokatalitikus tulajdonságait, mivel az additív hatására az enzim a katalitikusan aktív konfomációjában rögzül, mely állapotát a merev rögzítés miatt később is megőrzi [D].

Az aminok, alkoholok, karbonsavak fontos építőkövei lehetnek a gyógyszermolekuláknak, ezért nagy enantiomertisztaságú előállításuk különösen fontos kutatási terület. Enzimekkel megvalósítottuk ilyen típusú vegyületek szakaszos [E, F] és folyamatos [G, J] üzemű előállítását. Folyamatos üzemű kísérletekkel igazoltuk, hogy az átalakítandó vegyület szerkezete és az alkalmazott enzim rögzítési módja együttesen határozza meg a termékek enantiomertisztaságát [H].
Várható impakt, további kutatás
A kutatócsoport által elért eredmények nemzetközi kutatási együttműködésekhez (CMST COST Action CM0701) kapcsolódnak, és hazai (KMR_12) és nemzetközi (OTKA NN103242) pályázatok alapját képezik. A folyamatos együttműködés ipari partnereinkkel biztosítja a későbbi nagyüzemi megvalósítás lehetőségét, valamint azt, hogy a kutatások iránya mindvégig piacorientált maradjon.
Távolabbi célunk az elért eredmények alapján a technológiák általánosíthatóságának és alkalmazási területeinek kiterjesztése [I]. A fémek kötésére alkalmas biokompatibilis hordozók fehérjék tisztításán felül kiválóan alkalmazhatóak többek között természetes vizek (nehéz)fém-mentesítésére.
Jelenleg is futó projektek kereteiben belül kívánjuk megvalósítani a kidolgozott fehérjetisztítási és enzimrögzítési eljárások teljes automatizálását, számítógép-vezérelt ipari robotok alkalmazásával.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája
Folyóiratcikk:
[A] M. Oláh, Z. Boros, P. Sátorhelyi, V. Bódai, E. Balázs, L. Poppe: Kinetic resolution of racemic 1-phenylethanamine catalyzed by lipase B from Candida antarctica – Effect of the acylating agent and the mode of enzyme immobilization, Stud. Univ. Babes-Bolyai, Chem, 2012, közlésre elfogadva
[B] E. Abaháziová, Z. Boros, P. Kovács, L. Poppe: Surface modification of silica gels for selective adsorption of bacterial lipases, Stud. Univ. Babes-Bolyai, Chem, 2012, közlésre elfogadva
[C] D. Weiser, Z. Boros, G. Hornyánszky, A. Tóth, L. Poppe: Disubstituted dialkoxysilane precursors in binary and ternary sol-gel systems for lipase immobilization, Process Biochemistry, 2012, 47, 428-434.
[D] G. Hellner, Z. Boros, A. Tomin, L. Poppe: Novel sol-gel lipases by designed bioimprinting for continuous-flow kinetic resolutions, Advanced Synthesis & Catalysis, 2011, 353, 2481-2491.
[E] P. Falus, Z. Boros, G. Hornyánszky, J. Nagy, L. Ürge, F. Darvas. L. Poppe: Synthesis and lipase catalysed kinetic resolution of racemic amines, Stud. Univ. Babes-Bolyai, Chem, 2010, 55, 289-296.
[F] J. Brem, M. Naghi, M. Tosa, Z. Boros, L. Poppe, F. Irimie, C. Paizs: Lipase mediated sequential resolution of aromatic β-hydroxy esters using fatty acid derivatives, Tetrahedron: Asymmetry, 2011, 22, 1672-1679.
[G] Z. Boros, M. Szigeti, A. Tomin, P. Kovács, L. Ürge, F. Darvas, L. Poppe: Asymmetric biotransformations in continuous flow reactors, Stud. Univ. Babes-Bolyai, Chem, 2009, 54, 69-75.
[H] Z. Boros, P. Falus, M. Márkus, D. Weiser, M. Oláh, G. Hornyánszky, J. Nagy, L. Poppe: How the mode of Candida antarctica lipase B immobilization effects the continuous-flow kinetic resolution of racemic amines at various temperatures, Journal of Molecular Catalysis B: Enzymatic, 2012, közlésre elfogadva
[I] P. Falus, Z. Boros, G. Hornyánszky, J. Nagy, L. Ürge, F. Darvas. L. Poppe: Reductive amination of ketones: novel one-step transfer hydrogenations in batch and continuous-flow mode, Tetrahedron Letters, 2011, 52, 1310-1312.
Szabadalom:
[J] Poppe L., Tomin A., Boros Z., Varga E., Ürge L., Darvas F.: Új dinamikus kinetikus reszolválási eljárás, Magyar Szabadalmi Bejelentés, P0900720, 2009.
[K] Poppe L., Boros Z., Vértessy B., Kovács K., Tóth A., Hornyánszky G., Nagy J., Erdélyi B., Bódai V., Sátorhelyi P.: Fémkomplexáló ligandumokkal és stabilitásnövelő csoportokkal módosított felszínű affinitás anyagok és lantanida fémionok alkalmazása fehérjék megkötésére és tisztítására, Magyar Szabadalmi Bejelentés, P1200327, 2012.
Egyetemi jegyzet:
[L] Poppe L. (szerk.), Nagy J., Hornyánszky G., Boros Z.: Sztereoszelektív szintézisek; Typotex Kft., 2011, ISBN 978-963-279-486-0
Linkgyűjtemény
BME Szerves Kémia és Technológia Tanszék
