|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME VBK, Szervetlen és Analitikai kémia Tanszék
Témavezető: Dr. Horváth Viola
Szelektív fehérje-felismerés molekuláris lenyomatú polimerekkel
A kutatási téma néhány soros bemutatása
Molekuláris lenyomatképzéssel egy kiválasztott célvegyület szelektív felismerésére és megkötésére alkalmas polimerek állíthatók elő. Kis méretű célvegyületek esetében már kereskedelmi forgalomban is kaphatóak molekuláris lenyomatú polimer (MIP) szorbensek; a nagy méretű molekulák (pl. fehérjék) lenyomatképzése azonban még gyerekcipőben jár. Olyan új módszerek fejlesztésén dolgozom, amelyek segítségével a fehérje-imprintelés nehézségei leküzdhetőek, és így az előállított MIP-ek fehérje-szenzorok érzékelő rétegeként hasznosíthatóak.
A kutatóhely rövid bemutatása
A Szervetlen és Analitikai Kémia Tanszéken működő Farmakokinetikai Kutatócsoport az ezredforduló óta foglalkozik molekuláris lenyomatképzéssel. A kis méretű molekulák szelektív megkötésére alkalmas szorbensek fejlesztése [1-4] mellett a csoport a MIP-ek analitikai teljesítőképességének elméleti leírásával is foglalkozik [5-9]. Emellett újfajta polimerizációs eljárások kifejlesztésével a kutatócsoport a MIP-ek gyors optimalizálásában [10-11], a kromatográfiás alkalmazásban fontos gömbszerű polimer szemcsék egyszerű előállításában [B1, 12], valamint a nagyobb méretű célvegyületek (pl. fehérjék) lenyomatképzésében is élen jár [B2, 13-15].
A kutatás történetének, tágabb kontextusának bemutatása
Az orvosi gyakorlatban egy diagnózis felállításához, illetve a krónikus betegségek terápiája esetén a gyógyszerszint megfelelő beállításához napi szinten szükség lehet különböző biomakromolekulák koncentrációjának mérésére. Számos ilyen mérést immunoassay-ek segítségével végeznek. Ezekben egy ún. antitest választja ki és köti meg a bonyolult mintából (pl. vérből) a mérni kívánt komponenst (antigént). Az antitest-antigén kölcsönhatás igen erős és szelektív, de az antitestek nagyon bomlékonyak. Sokkal robusztusabb, “műanyag antitestek” állíthatóak elő az ún. molekuláris lenyomatképzés segítségével.
Ezek a molekuláris lenyomatú polimerek (molecularly imprinted polymer; MIP) a természetes antitest-antigén kölcsönhatáshoz hasonló szelektivitással és affinitással képesek megkötni egy kiválasztott vegyületet. A MIP-eket a megkötni kívánt vegyület mint templát segítségével állítják elő: a célszerűen megválasztott monomerek a templát köré rendeződnek, azzal kovalens vagy másodlagos kötéseket alakítanak ki, majd ebben az elrendezésben rögzülve polimerizálódnak. A kapott szilárd, erősen keresztkötött tömbpolimert mozsárban összetörik, és szitafrakcionálják. A templát ezután kimosható a kapott polimer szemcsékből, így olyan üregeket hagy hátra, melyek alakja és funkciós csoportjainak elrendezése a templát komplementerét alkotja (1. ábra). A polimer felhasználásakor ezen visszamaradt üregekbe tud ismét bekötődni a célvegyület; a kimosáskor felszakadt kötések újraképződésével. A lenyomatképzés sikerességének vizsgálatához egy referencia polimert is szoktak készíteni, melyet nem-imprintelt polimernek, NIP-nek neveznek. Ezt a MIP-pel teljesen azonos módon állítják elő, egyedül a templátot nem adják hozzá a polimerizációs elegyhez.
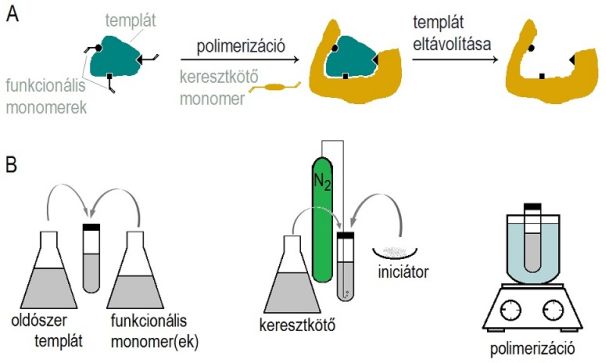
1. ábra: Molekuláris lenyomatképzés sematikus menete (a)
és a hagyományos szintézis lépései (b)
A kisméretű molekulák lenyomatképzésének számos sikeres példáját publikálták, különféle alkalmazási területeken (katalízis, szenzorok, elválasztás, hatóanyag-célbajuttatási feladatok), ezzel szemben a fehérjék imprintelésének még viszonylag szűkös az irodalma. Ennek oka a fehérjék nagy mérete és komplex szerkezete miatt fellépő nehézségekben keresendő. A hagyományos tömbpolimerizáció alkalmatlan a biomakromolekulák lenyomatképzésére, mivel ezek mozgása erősen gátolt a sűrűn keresztkötött polimerhálóban, így nehezen jutnak el a mintaoldatból a polimer belsejében lévő kötőhelyekre.
A kutatás célja, a megválaszolandó kérdések
A fehérjék lenyomatképzésére alapvetően két stratégia terjedt el, amelyek a hagyományos, erősen keresztkötött tömbpolimerizációs eljáráson alapulnak, de különböző módon segítik elő a fehérje mozgását a polimerben. Az egyik lehetőség a diffúziós állandó növelése azáltal, hogy jelentősen lecsökkentjük a polimer keresztkötöttségét a hagyományos tömbpolimerekéhez képest, vagyis géleket állítunk elő.
A másik megoldás a diffúziós úthossz csökkentése: ekkor a lenyomatokat jobban őrző, erős keresztkötöttséget megtartjuk, de a lenyomatokat kizárólag a polimer felszínén alakítjuk ki, ezáltal megkönnyítve a mintafázis és a polimer közötti szabad anyagátmenetet.
Megjegyzendő, hogy a tömbpolimerizáció során is létrejönnek véletlenszerűen felületi lenyomatok, de a MIP térfogatához képest elenyésző mértékben. Kellően nagy kapacitású MIP előállításához a kötőhelyek létrejöttét kifejezetten a felületre kell koncentrálni, továbbá olyan szintézismódszert kell választani, amely nagy felület/térfogat arányú polimert eredményez. Ez legjobban különböző nanostruktúrák előállításával valósítható meg.
Munkám során egy nanoszféra-litográfián alapuló módszert dolgoztam ki, amellyel felületi fehérje-lenyomatot tartalmazó vékony polimer filmek állíthatók elő. Modell fehérjeként a tojásfehérjében található avidint választottam. A célfehérjét szubmikronos méretű gyöngyökhöz rögzítettem, majd e gyöngyökből kompakt réteget alakítottam ki a hordozó felületén (2. ábra). A gyöngyök közötti teret ezután polimerrel töltöttem ki, amelyben a polimerizáció során kialakult a gyöngyök és az azokon elhelyezkedő fehérjemolekulák lenyomata. Végül a gyöngyök eltávolításával kaptam meg az imprintelt polimerfelszínt.
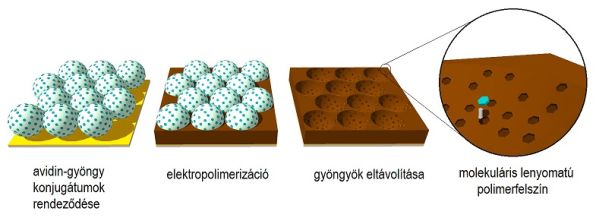
2. ábra: Nanoszféra litográfián alapuló fehérje-imprintelés lépései
Módszerek
A célfehérjét egy bontható kötést is tartalmazó távtartó segítségével kapcsoltam a polisztirol anyagú, 750 nm átmérőjű gyöngyökhöz (3. ábra). Erre azért volt szükség, mert a templát eltávolítása során a gyöngyöket toluolban terveztük feloldani. A szerves oldószerben azonban a fehérje kicsapódott, és meggátolta a gyöngyök kioldását a polimer filmből. Ha azonban a távtartó megbontásával (egy diszulfid kötés redukciójával) előbb eltávolítottam a fehérjét a gyöngyök felületéről, akkor a polisztirol gyöngyök már teljesen fel tudtak oldódni toluolban. A gyöngyök fehérje-módosításának sikerességét a felületi zeta-potenciáljuk mérésével vizsgáltam.
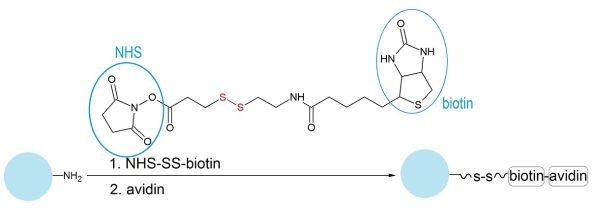
3. ábra: Avidin kapcsolása felületi amino-csoportokat tartalmazó polisztirol (PS) gyöngyhöz, az avidin-biotin kölcsönhatást kihasználva
A gyöngyökből egy, a nanoszféra litográfiában közkeletű eljárással, az ún. cseppentéses bevonatképzéssel alakítottam ki kompakt réteget egy arany bevonatú hordozón. A módszer lényege tulajdonképpen a gyöngyök szuszpenziójának felcseppentése a hordozóra, majd a csepp lassú beszárítása, mialatt a nanogyöngyök önszerveződéssel kompakt rétegbe tömörülnek. A réteget pásztázó elektronmikroszkóppal vizsgáltam. A választott monomerből (EDOT; 3,4-etiléndioxitiofén, nátrium poli(sztirol-szulfonát) elektrolitban) elektrokémiai úton, állandó feszültség alkalmazásával választottam le a polimert a gyöngyök közötti térbe. A leválasztott polimer vastagságát a polimerizáció során áthaladt töltés mennyiségével szabályoztam. A különböző töltésmennyiséggel létrehozott polimer-filmeket atomerő mikroszkóppal vizsgáltam. Az optimális töltésmennyiséget úgy határoztam meg, hogy a polimerfilm a gyöngyöket félig ágyazza be - geometriai megfontolások alapján ugyanis ekkor maximális az elérhető imprintelt/nem-imprintelt felület-arány. A lenyomatok alján hátramaradt arany felületet (ahol a gyöngyök hozzáértek a hordozóhoz) egy hidrofil tiol-vegyületből képezett önszerveződő monoréteggel vontam be, így kiküszöbölhető a fehérjék erős nemspecifikus adszorpciója az aranyon. A polimer-filmeken kvarc kristály mikromérleg technikával vizsgáltam a cél- illetve egyéb fehérjék kötődését. A polimer-módosítású kristályt egy 120 μl térfogatú átfolyócellába helyeztem, amelyen 60 μl/perc sebességgel pufferoldatot áramoltattam keresztül. 250 μl, különböző koncentrációjú fehérje-oldatot injektáltam a cellába, miközben regisztráltam a kristály rezonancia frekvenciáját. A polimer felületén megkötött fehérje mennyiségét az okozott frekvencia-változásából, a Sauerbrey-egyenlet segítségével határoztam meg.
Eddigi eredmények
A gyöngyök fehérje-módosítása és rendezése
Mivel egy avidin molekula négy biotin-kötőhellyel rendelkezik, ezért a fehérje-kapcsolási lépésben optimalizálni kellett az alkalmazott avidin-felesleget és a biotinilált gyöngyök koncentrációját annak érdekében, hogy visszaszorítsuk a gyöngyök fehérje általi keresztkötését. A magas izoelektromos pontú (pI=10,5), vagyis az alkalmazott pH-n erősen pozitív töltésű avidin felvitelét követően a gyöngyök felületi zeta-potenciálja pozitív irányba tolódott (4. ábra).
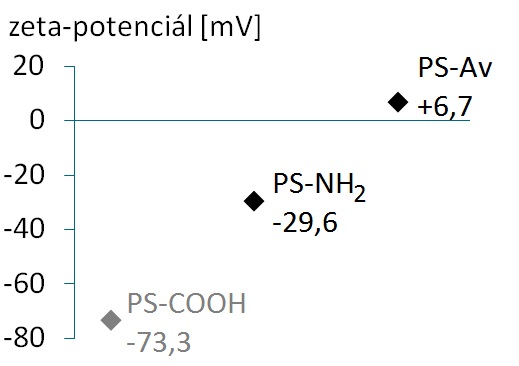
4. ábra: Az avidin-kapcsolás sikerességét bizonyítja, hogy az aminos gyöngyök felületi zeta-potenciálja pozitív irányba tolódott.
(Megjegyzendő, hogy a felületen kötött alifás aminok pKa értéke jelentősen alacsonyabb lehet (4-4,5) az oldatfázisban mért értéknél (9-10) [16] - ez megmagyarázza az aminos gyöngyök negatív felületi zeta-potenciálját. Összehasonlításképpen feltüntettem a felületükön karboxil-csoportokat tartalmazó gyöngyök felületi zeta-potenciálját is.)
Az aminos felületű (nem-imprintelt polimer előállításához használt) gyöngyök hexagonális rendbe szerveződtek a cseppentéses bevonatképzés során (5. ábra a). Ezzel szemben a fehérje-módosítású gyöngyökből nem tudott kompakt réteg kialakulni: a tömött monoréteghez szükséges részecskeszám beszárítása a hordozón - a gyöngyök ritkább, véletlenszerű elhelyezkedése miatt - több réteg kialakulását eredményezte (5. ábra b). Habár a gyöngyök kompakt rendeződése nagyobb imprintelt felületet eredményezne, a nanoszféra litográfia egyéb alkalmazásaival (pl. optikai eszközök készítése) ellentétben számunkra nem volt elengedhetetlen a hexagonális rendezettség.

5. ábra: (a) Referencia és (b) avidin-módosítású gyöngyökből cseppentéses bevonatképzéssel kialakított réteg elektronmikroszkópos felvétele. A lépték 10 µm.
Elektrokémiai polimerizáció, templát eltávolítás
A gyöngyök közé különböző töltésmennyiségekkel leválasztott polimer filmek atomerő mikroszkópos felvételein (6. ábra) jól látható, hogy az egyre vastagabb polimerek a gyöngyök egyre nagyobb részét ágyazzák be: a lenyomatok mélysége növekszik, átmérőjük pedig a gyöngy átmérőjének eléréséig növekszik (A-C), majd ahogy a polimer túlnövi a gyöngyök „egyenlítőjét”, úgy ismét csökkenni kezd (D). Az optimális, a gyöngyöket éppen félig beágyazó polimervastagsághoz tartozó töltésmennyiséget interpolációval 17 mC/cm2-ben állapítottam meg.

6. ábra: Különböző töltésmennyiségekkel növesztett polimer filmek felszíne a templát gyöngyök kioldása után - atomerő mikroszkópos felvételek, illetve az első sorban jelölt vonalak menti magasságprofilok.
A templát eltávolítása két lépésben történt: először a távtartó diszulfid kötését redukáltam, ezzel lehasítottam a fehérjemolekulákat a gyöngyök felszínéről. Ezután a polimer filmet toluolba áztattam, így a gyöngyök könnyen feloldódtak (a PEDOT/PSS polimert nem károsította a toluol). Nem-imprintelt polimerek segítségével megmutattam, hogy a templát-eltávolításkor előbukkanó arany területek blokkolása egy hidrofil monoréteggel valóban csökkenti a fehérjék nemspecifikus adszorpcióját (7. ábra b).
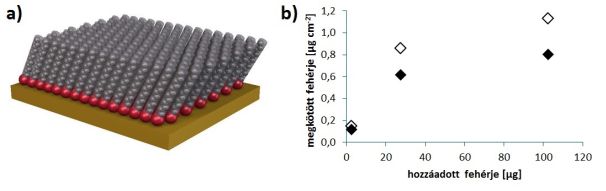
7. ábra: (a) Önszerveződő monoréteg – a vegyület tiol csoportjaival (piros) kötődik az aranyhoz, míg a szürkével jelölt (esetünkben egy 11-szénatomos alkilláncot követő tetra(etilénglikol)) lánc ellenáll a fehérje-adszorpciónak [17].
(b) A templát kioldása után HS-TEG-gel kezelt felületen (teli rombuszok) mintegy 30%-kal kevesebb fehérje kötődött meg, mint a kezeletlen felületen (üres rombuszok).
Fehérjék kötődése a polimer filmeken
A 8. ábrán látható az imprintelés hatása: míg maga a PEDOT/PSS anyag (nem-imprintelt polimer) csupán 0,21 μg/cm2 avidint kötött meg, addig a specifikus lenyomatok segítségével ez a kapacitás 6,5-szeresére nőtt. Ez az ún. lenyomatképzési faktor a fehérje-lenyomatot tartalmazó MIP-ek irodalmában kiemelkedőnek számít.
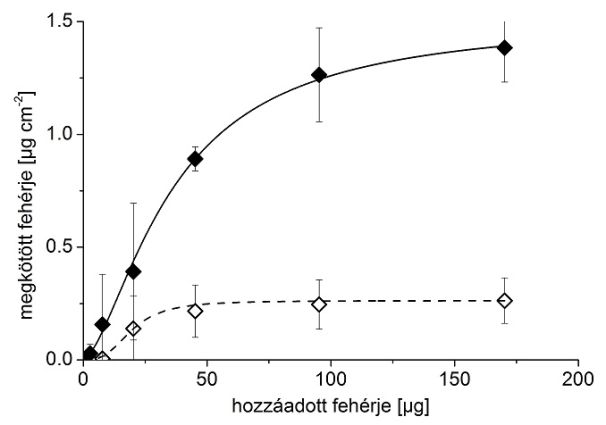
8. ábra: Avidin kötődése imprintelt (teli rombuszok) és nem-imprintelt (üres rombuszok) polimeren
A kötőhelyek szelektivitását úgy vizsgáltam, hogy különböző avidin-analógok, valamint más fehérjék kötődését is mértem a polimer filmeken. A 9. ábrán látható, hogy az avidin deglikozilált formáit (Neutravidin - NA, Extravidin – EA), valamint egy, az avidinhoz szerkezetében igen hasonló fehérjét, a Streptavidint (SA) csupán elenyésző mértékben kötötték meg a polimerek. Az avidinnel közel azonos méretű marhaszérum albuminból (BSA) is igen kevés kötődött.
Az alkalmazott pH-n az avidinhez hasonlóan pozitív töltésű lizozim (Lys) jelentős kötődése arra utal, hogy a molekulafelismerésben kiemelt szerepe van az elektrosztatikus kölcsönhatásoknak.
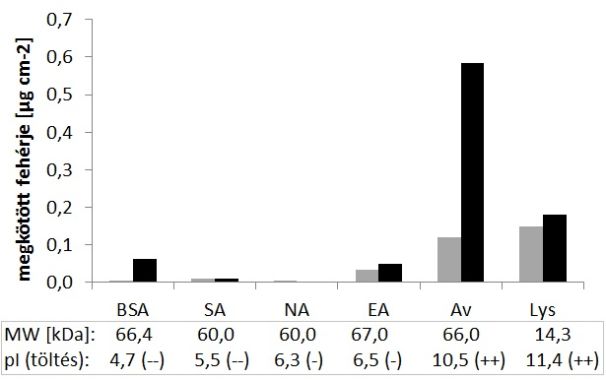
9. ábra: Különböző fehérjék kötődése MIP (fekete) és NIP (szürke) filmeken.
A vizsgált fehérjék méretét (MW) és izoelektromos pontját (pI), ill. az alkalmazott pH-n (7,4) mutatott töltését is feltüntettem.
Várható impakt, további kutatás
Kidolgoztam egy nanoszféra litográfián alapuló molekuláris lenyomatképzési eljárást, amellyel kiemelkedő lenyomatképzési faktort, és jelentős szelektivitást sikerült elérni a célvegyülettel rokon fehérjékkel szemben. Munkám részét képezte a (Bio)kémiai érzékelés funkcionalizált nanoszerkezetekkel című kutatóegyetemi alprojektnek (TÁMOP-4.2.1/B-09/1/KMR-2010-0002 NNA-P4-T1). Eredményeimet az Advanced Functional Materials (IF2012=9,765) címlapon közölte [B3], munkámat hazai és nemzetközi konferenciákon is bemutattam [B4-9].
A nanoszféra-litográfia alapú lenyomatképzés egyik előnye, hogy a gyöngyök fehérje-borítottságának változtatásával szabályozható a létrehozott polimer film kötőhely-sűrűsége. Jelenleg egy olyan módszeren dolgozunk, amellyel a fehérje-módosítású gyöngyök is kompakt rétegbe rendezhetőek; ezzel várhatóan tovább javul a MIP analitikai teljesítőképessége. Terveink között szerepel még a lenyomatképzési eljárás gazdaságosabbá tétele azáltal, hogy a fehérjét mágneses gyöngyökhöz kapcsoljuk, így a templát a lenyomatképzés után visszanyerhető.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája
Folyóiratcikkek
[B1] Horváth, V., Lorántfy, B.; Tóth, B.; Bognár, J.; László, K.; Horvai, G., J. Sep. Sci., 2009, 32 (19) 3347. IF=2,551
[B2] Bognár, J.; Szűcs, J.; Dorkó, Z.; Horváth, V.; Gyurcsányi, R.E., Adv. Funct. Mater., 2013, 23 (37) 4703. IF=9,765 (2012)
[B3] Bognár, J.; Szűcs, J.; Dorkó, Z.; Horváth, V.; Gyurcsányi, R.E., Adv. Funct. Mater., 2013, 23 (37) 4641.
Konferenciák
[B4] Bognár, J.; Horváth, V.; Gyurcsányi, R.E.: Towards surface-imprinted nanostructures for selective protein recognition. Graduate Student Symposium on Molecular Imprinting, 2011, London (poszter)
[B5] Bognár, J.; Lautner, G.; Syritski, V.; Horváth, V.; Gyurcsányi, R.E.: Surface-imprinted nanostructures for selective protein recognition. Mátrafüred 2011 International Conference on Electrochemical Sensors, 2011, Dobogókő (poszter)
[B6] Bognár, J.; Szűcs, J.; Gyurcsányi, R.E.; Horváth, V.: Towards surface-imprinted nanostructures for selective protein recognition. 7th International Conference on Moleculary Imprinted Polymers – Science and Technology, 2012, Párizs (poszter)
[B7] Bognár, J.; Szűcs, J.; Dorkó, Z.; Horváth, V.; Gyurcsányi, R.E.: Nanosphere lithography as a versatile method to generate surface-imprinted polymer films for selective protein recognition. Graduate Student Symposium on Molecular Imprinting, 2013, Belfast (előadás)
[B8] Bognár, J.; Szűcs, J.; Dorkó, Z.; Horváth, V.; Gyurcsányi, R.E.: Szelektív fehérje-felismerés nanoszféra-litográfián alapuló molekuláris lenyomatképzéssel. A szenzorkutatás újabb eredményei Workshop V., 2013, Pécs (előadás)
[B9] Bognár, J.; Szűcs, J.; Dorkó, Z.; Horváth, V.; Gyurcsányi, R.E.: Selective protein recognition with surface molecularly imprinted polymer films prepared by nanosphere lithography. Mátrafüred 2014 International Conference on Electrochemical Sensors, 2014, Visegrád (poszter)
Linkgyűjtemény
Molekuláris lenyomatú polimer (angol)
Nanoszféra (vagy kolloid) litográfia
Hivatkozások listája
[1] Ferrer, I.; Lanza, F.; Tolokán, A.; Horváth, V.; Sellergren, B.; Horvai, G.; Barceló, D., Anal. Chem. 2000, 72 (16) 3934.
[2] Pap, T.; Horváth, V.; Tolokán, A.; Horvai, G.; Sellergren, B., J. Chrom. A, 2002, 973 (1-2) 1.
[3] Bereczki, A.; Tolokán, A.; Horvai, G.; Horváth, V.; Lanza, F.; Hall, A.J.; Sellergren, B., J. Chrom. A, 2001, 930 (1-2) 31.
[4] Pap, T.; Horvai, G., J. Chrom. A, 2004, 1034 (1-2) 99.
[5] Pap, T.; Horvai, G., J. Chrom. B, 2004, 804 (1) 167.
[6] Tóth, B.; László, K., Horvai, G., J. Chrom. A, 2005, 1100 (1) 60.
[7] Tóth, B.; Pap, T.; Horváth, V.; Horvai, G., J. Chrom. A, 2006, 1119 (1-2) 29.
[8] Tóth, B.; Pap, T.; Horváth, V.; Horvai, G., Anal. Chim. Acta, 2007, 591 (1) 17.
[9] Tóth, B.; Pap, T.; Horváth, V.; Horvai, G., Magyar Kém. Foly., 2005, 111 (3) 110.
[10] Lanza, F.; Hall, A.J.; Sellergren, B.; Bereczki, A.; Horvai, G.;Bayoudh, S.; Cormack, P.A.G.; Sherrington, D.C., Anal. Chim. Acta, 2001, 435 (1) 91.
[11] Ceolin, G.; Navarro-Villoslada, F.; Moreno-Bondi, M.C.; Horvai, G.; Horváth, V., J. Comb. Chem., 2009, 11 (4) 645.
[12] Renkecz, T.; László, K.; Horváth, V., J. Mol. Recogn., 2012, 25 (6) 320.
[13] Ceolin, G.; Orbán, Á.; Kocsis, V.; Gyurcsányi, R.E.; Kézsmárki, I.; Horváth, V., J. Mater. Sci., 2013, 48 (15) 5209.
[14] Menaker, A.; Syritski, V.; Reut, J.; Öpik, A.; Horváth, V.; Gyurcsányi, R.E., Adv. Mater., 2009, 21 (22) 2271.
[15] Lautner, G.; Kaev, J.; Reut, J.; Öpik, A.; Rappich, J.; Syritski, V.; Gyurcsányi, R.E., Adv. Funct. Mater., 2011, 21 (3) 591.
[16] Vezenov, D.V.; Noy, A.; Rozsnyai, L.F.; Lieber, C.M., J. Am. Chem. Soc., 1997, 119 (8) 2006.
[17] http://www.personal.psu.edu/acs5112/ART101/art101ass5.html
