|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME VBK, Szerves kémia és technológia Tanszék
Témavezető: Dr. Marosi György
Elektrosztatikus nanoszálképzés és szuperkritikus fluidummal segített extrúzió alkalmazása azonnal oldódó gyógyszerkészítmények előállítására
A kutatási téma néhány soros bemutatása
Kutatásunkban olyan innovatív technológiákat vizsgálunk, amelyek összhangban állnak a gyógyszergyártás és -analitika területén a 21. században meghonosítani kívánt radikálisan új szemléletmóddal. Több vegyület példáján megmutattuk, hogy a szuperkritikus szén-dioxiddal segített extrúzió és az elektrosztatikus szálképzés olyan hatóanyagokat menthet meg a gyógyászat számára, amelyek vízoldhatósága egyébként nehezítené vagy megakadályozná, hogy gyógyszerként alkalmazzák őket. Tapasztalataink szerint a transzmissziós Raman-spektrometria – korszerű analitikai módszer lévén – alkalmas a készítmények széles körű jellemzésére.
A kutatóhely rövid bemutatása
A Biztonság- Környezet- és Gyógyszertechnológiai Kutatócsoport olyan anyagtudományi és technológiai kutatások iránt elkötelezett, amelyek az életminőség javítását szolgálják. A gyógyszeriparon belül ezt a biztonságos, kontrollált, folyamatos és integrált gyógyszertechnológia kifejlesztését szolgáló kutatásokkal, a járműipar területén a tűzbiztonság és megújuló nyersanyagok alkalmazása érdekében végzett kutatásokkal, a környezetvédelem területén pedig műanyaghulladékok újrahasznosításával igyekszünk megvalósítani.
A kutatás történetének, tágabb kontextusának bemutatása
A világ gyógyszergyártásában egy kényszerű, de igen hasznos szemléletváltás kezdődött el. Az intenzívebbé váló verseny a ma már elavultnak számító termelési, fejlesztési és minőségügyi koncepciók felülvizsgálatára szorítja rá a piaci résztvevőket [1,2]. Az iparág kiadásainak 36%-át termelésre fordítják [3], ahol egyes folyamatok esetében a selejtarány akár az 50%-ot is elérheti [4], jelentős költségterhet róva a vállalatokra.
Megoldást olyan, célszerűen folyamatos működési elvű gyártósorok alkalmazása jelenthet, amelyek viselkedését előzetesen részletesen feltérképezik fejlett statisztikai és kockázatelemzési eszközökkel, amelyekben a feldolgozott anyag állapotát valós időben nyomon követik, és amelyek szabályozhatók. Az innovatív fejlesztés és gyártás keretrendszerét az amerikai gyógyszerhatóság irányelve (PAT) jelöli ki (1. ábra) [5].
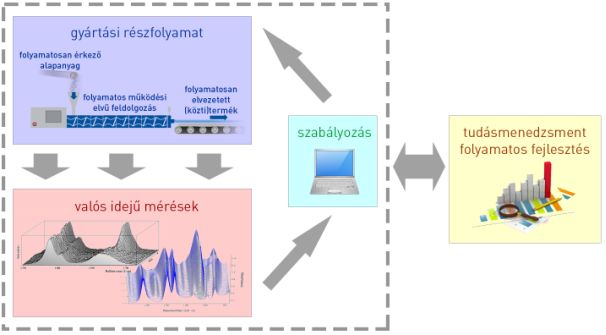
1. ábra: PAT irányelveken alapuló gyártás és fejlesztés sematikus ábrázolása
Az általunk vizsgált elektrosztatikus nanoszálképzés és szuperkritikus fluidummal segített ömledékextrúzió – megfelelő analitikai technikákkal ellátva – e korszerű gyártósorok fontos építőelemei lehetnek, és mindemellett egy fontos gyógyszerészeti problémára, az újonnan felfedezett hatásos vegyületek gyenge vízoldhatóságára is megoldást jelenthetnek.
A kutatás célja, a megválaszolandó kérdések
1. kihívás: Hatóanyagok gyenge oldódásának javítása nagy fajlagos felületű amorf készítmények előállításával
A társadalom jogos elvárása, hogy minél több betegség ellenszerét megtalálják, és forgalomba hozzák. Az utóbbi években felfedezett, receptorokon hatásosnak talált, jellemzően kristályos vegyületek 90 százaléka azonban rosszul oldódik vizes közegben (például a gyomorban) [6]. Szisztémás hatáshoz a vegyületnek fel kell oldódnia a szervezetben, továbbá fel kell szívódnia a véráramba, amelyen keresztül a megfelelő receptorhoz eljut. Speciális készítmények előállításával azonban biztosítható a problémás vegyületek hasznosulása (2. ábra) [V5, V8].

2. ábra: Rosszul oldódó, de megfelelő permeabilitású vegyületek biohasznosulásának javítása szuperkritikus fluidummal segített extrúzióval és elektroszálképzéssel
2. kihívás: A szervezetbeli kicsapódás megakadályozása
Amikor egy vizes közegben alig oldódó vegyület kioldódását javítjuk, fennáll annak a veszélye, hogy az túlságosan gyorsan oldatba kerül, ezért a szájon keresztül adagolt hatóanyag csapadékként kiválik az emésztőrendszerben a helyi túltelítődés miatt. Ez szintén akadályozza a felszívódást, és kiszámíthatatlanná teszi a szervezetbeli viselkedést. Ezért célunk volt, hogy megfelelő formuláció kifejlesztésével ezt gátoljuk.
3. kihívás: Terméktulajdonságok becsülhetőségének vizsgálata neminvazív analitikai módszerrel
A gyógyszerfejlesztés és -gyártás modern szemléletmódjának megfelelően a készítménygyártás során a feldolgozás alatt álló anyag állapotát folyamatosan követni szükséges. Kutatásunkban a legelőnyösebb, ún. in-line módban is használható transzmissziós Raman-spektrometriával vizsgáltuk a hatóanyagot tartalmazó, gyorsan oldódó nanoszövedékeket és szilárd habokat.
Módszerek
Munkánkban a gyenge vízoldhatóságú kristályos hatóanyagokból elektrosztatikus szálképzéssel és szuperkritikus fluidummal segített extrúzióval állítottunk elő gyorsan oldódó készítményeket (szövedékeket, ill. szilárd habokat). Az eljárások során a hatóanyag részecskéit, ill. molekuláit segédanyagban oszlattuk el. E segédanyag (mátrix) tulajdonságai tették lehetővé, hogy a keverékből szálakat vagy habokat tudjunk képezni.
Nano- és mikroszövedékek előállítása
A hatóanyagokat elektrosztatikus szálképzéssel ágyaztuk nano- és mikroszövedékbe (3. ábra). A mátrixképző segédanyagok és a hatóanyag közös oldatát egy nagyfeszültség alatt álló porlasztófejre tápláltuk egy pumpa segítségével. A potenciálkülönbség miatt az anyag ultrafinom sugarak formájában indult el a földelt gyűjtő irányába, miközben az oldószer pillanatszerűen elpárolgott. A megszáradt, hatóanyagot tartalmazó extrém vékony polimerszálak nagy fajlagos felületű szövedékké álltak össze.
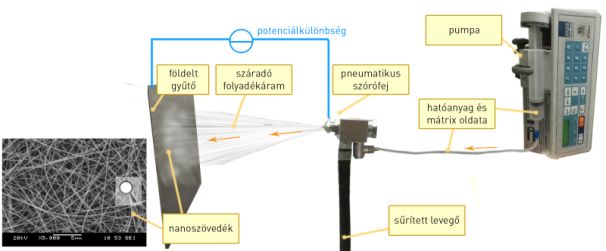
3. ábra: Az elektrosztatikus szálképzés folyamatának illusztrációja
Szilárd habok előállítása
A szilárd habok előállításához először létrehoztuk a hatóanyag és a polimer mátrixképző fizikai keverékét, majd ezt egy egycsigás extrúderbe tápláltuk (4. ábra), ahol a saját tengelye körül forgó csiga által szállított polimer hőközlés hatására megömlött, azaz formálhatóvá vált. Ezt szuperkritikus állapotú szén-dioxiddal elegyítettük, amely gázzá alakult a készüléket elhagyva, s ezáltal felhabosította a még képlékeny ömledéket, amelyben a hatóanyag eloszlott.
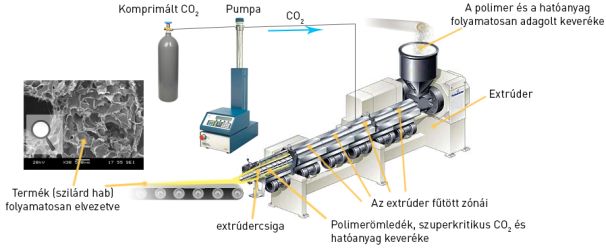
4. ábra: A szuperkritikus szén-dioxiddal segített extrúzió folyamata
A cseppfolyós szén-dioxidot úgy alakítottuk szuperkritikus állapotúvá, hogy nyomását és hőmérsékletét az anyagra jellemző kritikus értékek fölé állítottuk be. A szuperkritikus fluidumok tulajdonságai a folyadékokéra és gázokéra egyaránt hasonlítanak, ugyanis ilyen körülmények közt nem létezhet külön folyadék vagy gáz fázis.
Pásztázó elektronmikroszkópia
A szálképzett és extrudált termékek szerkezetét pásztázó elektronmikroszkóppal vizsgáltuk (5. ábra). Ez a készítmény felszínének meghatározott területét irányított, vékony elektronnyalábbal pásztázta végig, majd detektálta a besugárzás hatására kilökődő elektronokat. E jel feldolgozásával kaptuk az eredmények között ismertetett képeket.
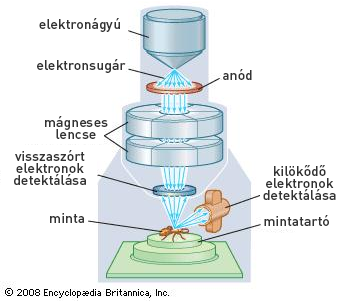
5. ábra: A pásztázó elektronmikroszkópia elve
© Encyclopædia Britannica, Inc.
A hatóanyag kioldódásának mérése
A szervezetbeli oldódást szabványos kioldókészülékben modelleztük (6. ábra). A kioldóedények 900 ml 1-es pH értékű sósavat tartalmaztak a gyomor kémhatásának biztosítása érdekében, melyet lapátos keverővel kevertettünk. Ebbe helyeztük a szövedékeket, ill. a habok őrleményét, és meghatározott időközönként ultraibolya-látható spektrofotometriával mértük a készítményekből kioldóközegbe oldódott hatóanyag mennyiségét.

6. ábra: Kioldódásmérő készülék
Transzmissziós Raman-spektrometria
A transzmissziós Raman-spektrometriás mérések során a vizsgálandó mintát meghatározott hullámhosszú (785 nm) (lézer)fénnyel sugároztuk be (7. ábra), majd a mintán átjutott szórt fotonok hullámhossz szerinti eloszlását vizsgáltuk. Ebből matematikai módszerekkel következtethettünk a minta kémiai összetételére, a vegyületekben jelen lévő funkciós csoportokra, ill. ezek környezetére. A kapott spektrum a besugárzott területnél jóval nagyobb mintatérfogatot jellemez, azaz a mérés nagy valószínűséggel reprezentatív.
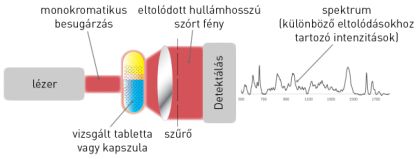
7. ábra: A transzmissziós Raman-spektroszkópia elve
Forrás alapján
Eddigi eredmények
1. A spironolakton kioldódásának javítása elektrosztatikus szálképzéssel
Sok esetben kívánatos lehet, hogy a szájon át beadott gyógyszerkészítmény néhány percen belül felszívódjon és kifejtse hatását, pl. migrén, láz, szívpanaszok, kiugró magas vérnyomás esetén. Az ehhez szükséges gyors kioldódást a gyenge oldhatóságú és jó permeabilitású, ún. BCS II típusú hatóanyagok esetében azonban csak speciális készítmények előállításával lehet biztosítani. A spironolakton egy magas vérnyomás kezelésére alkalmazott szteránvázas anyag, amely e problémás vegyületek megfelelő modelljeként szolgált.
A kifejlesztett, polivinilpirrolidon K90 (PVP) segédanyagon alapuló elektroszálképzett nanoszövedékek (8. ábra) nagy fajlagos felületűek voltak, és a hatóanyagot molekulárisan eloszlatva vagy amorf formában tartalmazták (röntgendiffrakció és Raman-spektrum alapján), megbontva ezzel a stabil, nehezen oldódó kristályrácsot. Mindezek lehetővé tették a hatóanyag kioldódásának drámai gyorsulását. Az ultragyors kioldódást azonban – a lokális túltelítődés következtében – rosszul oldódó csapadék kiválása követte (9. ábra). Hidroxipropil-β-ciklodextrin (HPβCD) komplexképző adalékolásával sikerült elkerülnünk ezt a hátrányos folyamatot, miközben tovább gyorsítottuk a kioldódást. Magas, 40% hatóanyag-tartalmú szálakat is sikerült előállítanunk, amelyek szintén teljes hatóanyag-felszabadulást tettek lehetővé 2 óra alatt.

8. ábra: 20% spironolaktont tartalmazó elektroszálképzett termékekről készült pásztázó elektronmikroszkópos felvételek
A mátrixok: (A) PVP K90, (B) HPβCD/PVP K90 1:3, (C) HPβCD; Forrás: [V4]
A PVP teljes elhagyásával elsőként állítottunk elő hatóanyagot tartalmazó HPβCD szálakat elektroszálképzéssel, etanolos oldatból kiindulva. Az így kapott teljesen amorf készítmény kedvező nedvesíthetőségének és a komplexképző segédanyag szolubilizáló hatásának köszönhetően 1 perc alatt közel teljes kioldódást biztosítottunk, kicsapódás nélkül (9. ábra). Ez akár szájban oldódó készítmények előállítására is alapot adhat. Az itt véráramba juttatott anyag elkerüli a májban történő first-pass lebontást, ezzel kímélve a méregtelenítő szervet.
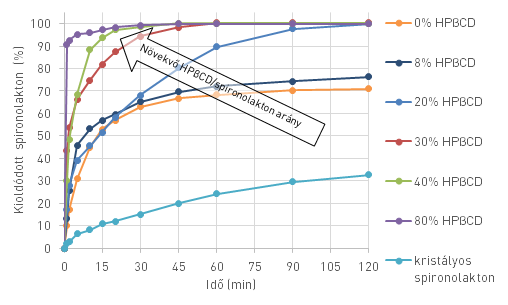
9. ábra: 20% spironolaktont, eltérő mennyiségű HPβCD-t és PVP K90-et tartalmazó elektroszálképzett spironolaktonkészítmények kioldódása, és a mikrokristályos spironolakton oldódása; Forrás: [V4]
2. A spironolakton kioldódásának javítása szuperkritikus szén-dioxiddal segített extrúzióval
Francia–magyar közös projekt keretében a spironolakton és prednizolon (egy másik szteránvázas hatóanyag) néhány mikronos falvastagságú szilárd habjait állítottuk elő szuperkritikus extrúzióval, Eudragit E polimer segítségével (10. ábra) [V1, V3, V10]. A hatóanyagok kioldódása e termékek esetében is számottevően gyorsult a megnövelt fajlagos felületnek köszönhetően.

10. ábra: 10% spironolaktont és 90% Eudragit E-t tartalmazó szilárd habokról készült pásztázó elektronmikroszkópiás felvételek; Forrás: [V1]
A tartózkodási idő és a feldolgozási hőmérséklet csökkentésével (amit a szuperkritikus CO2 tett lehetővé) kedvezőbb terméktisztaság volt elérhető, míg az amorfizáció mértéke nem csökkent jelentősen.
3. Készítménytulajdonságok becsülhetőségének vizsgálata Raman-spektrometriával
A PAT irányelveknek megfelelő innovatív gyártás kulcsfontosságú eleme a (közti)termékek széleskörű és valós idejű jellemzése. Munkánkban spironolakton-Eudragit E extrudátumok példáján bizonyítottuk off-line mérések segítségével, hogy a Raman-spektroszkópia és a mért adatok feldolgozását lehetővé tevő kemometriai módszerek használatával becsülhető a készítmények tisztasága, kristályosságának foka, továbbá a fizikai stabilitással kapcsolatban álló üvegesedési hőmérséklete (11. ábra) [V2]. Regresszióval összefüggéseket állítottunk föl, amelyek segítségével az említett terméktulajdonságok értékei megjósolhatók az alkalmazott feldolgozási körülményekből. A spektrométer 1-2 perc alatt értékelhető spektrumot szolgáltat, ezért alkalmas lehet gyártások valós idejű nyomon követésére.
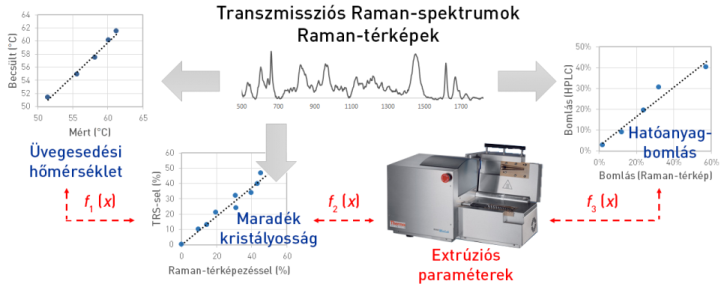
11. ábra: A Raman-spektrometria alkalmazása extrudátumok tisztaságának, amorfizációs fokának és üvegesedési hőmérsékletének becslésére; Forrás: [V2]
Várható impakt, további kutatás
Az újszerű folyamatos technológiák potenciálját jól mutatja, hogy az ömledékextrúziót már gyógyszeripari gyártásban is alkalmazzák [7,8]. A speciálisabb készülékigényű, ezért ez idáig kevésbé kutatott szuperkritikus fluidummal segített extrúzió további előnyöket jelenthet, ezért a továbbiakban szeretnénk minél több hatóanyagra kiterjeszteni a munkánk során megszerzett tapasztalatokat. Azt is vizsgálni kívánjuk, hogy a szuperkritikus szén-dioxid milyen körülmények között segíti a hatóanyagkristályok amorfizációját.
Az elektrosztatikus szálképzés nemcsak a kioldódásjavítás, hanem baktériumok formulálása [V7] és hordozós katalizátorok előállítása terén is előnyösen alkalmazható [V6, V9]. Mindkét technológia esetében célunk az analitikai jel segítségével történő szabályozás, azaz a PAT-kompatibilis gyártás megvalósítása.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája
[V1] T. Vigh, M. Sauceau, J. Fages, E. Rodier, I. Wagner, P.L. Sóti, G. Marosi, Z.K. Nagy Effect of supercritical CO2 plasticization on the degradation and residual crystallinity of melt-extruded spironolactone – Non-invasive testing of immediate-release solid dispersions Polymers for Advanced Technologies (2014) nyomdában
[V2] T. Vigh, G. Drávavölgyi, P.L. Sóti, H. Pataki, T. Igricz, I. Wagner, B. Vajna, J. Madarász, G. Marosi, Z.K. Nagy Predicting final product properties of melt extruded solid dispersions from process parameters using Raman spectrometry J. Pharm. Biomed. Anal. 98 (2014) 166–177. DOI: 10.1016/j.jpba.2014.05.025
[V3] T. Vigh, Z.K. Nagy, M. Sauceau, E. Rodier, J. Fages, G. Marosi Szuperkritikus szén-dioxiddal segített ömledékextrúzió alkalmazása gyógyszerkészítmények előállítására Műanyag- és gumiipari évkönyv (2014) pp. 67-72.
[V4] T. Vigh, T. Horváthová, A. Balogh, P. L. Sóti, G. Drávavölgyi, Z. K. Nagy, G. Marosi Polymer-free and polyvinylpirrolidone-based electrospun solid dosage forms for drug dissolution enhancement Eur. J. Pharm. Sci. 49 (2013) pp. 595–602.
[V5] A. Balogh, G. Drávavölgyi, K. Faragó, A. Farkas, T. Vigh, P.L. Sóti, I. Wagner, J. Madarász, H. Pataki, G. Marosi, Z.K. Nagy Plasticized drug-loaded melt electrospun polymer mats: characterization, thermal degradation and release kinetics J. Pharm. Sci. 103(4) (2014) 1278–1287. DOI: 10.1002/jps.23904
[V6] P.L. Sóti, L. Telkes, Z. Rapi, A. Tóth, T. Vigh, Z.K. Nagy, P. Bakó, G. Marosi Synthesis of an Aza Chiral Crown Ether Grafted to Nanofibrous Silica Support and Application in Asymmetric Michael Addition Journal of Inorganic and Organometallic Polymers and Materials (2014) DOI: 10.1007/s10904-014-0037-9
[V7] Z.K. Nagy, I. Wagner, Á. Suhajda, T. Tobak, A.H. Harasztos, T. Vigh, P.L. Sóti, H. Pataki, K. Molnár, G. Marosi Nanofibrous solid dosage form of living bacteria prepared by electrospinning eXPRESS Polymer Letters 8(5) (2014) 352–361.
[V8] H. Pataki, P. Soti, T. Vigh, Z.K. Nagy, B. Vajna, I. Csontos, G. Marosi Controlled Formation of Free-Flowing Carvedilol Particles in the Presence of Polyvinylpyrrolidone Chemical Engineering & Technology 37(2) (2014) pp. 249-256.
[V9] P. Bakó, Z. Rapi, G. Keglevich, T. Szabó, P.L. Sóti, T. Vigh, A. Grün, T. Holczbauer Asymmetric C-C bond formation via Darzens condensation and Michael addition using monosaccharide-based chiral crown ethers Tetrahedron Letters 52 (2011) pp. 1473–1476.
[V10] T. Vigh, M. Sauceau, E. Rodier, Z. K. Nagy, G. Marosi, J. Fages Dispersion of an Active Pharmaceutical Ingredient in Eudragit E100 by Melt Extrusion Coupled with Supercritical Carbon Dioxide, 6th International Symposium on High Pressure Processes Technology, Belgrád, Szerbia, 2013. szeptember 9.
In: D. Skala, A. Dekanski (ed.) 6th International Symposium on High Pressure Processes Technology Proceedings, pp. 33-39. ISBN: 978-86-905111-2-9 (Belgrád, 2013)
Továbbá 6 szóbeli előadás és 3 poszter hazai és nemzetközi konferenciákon.
Linkgyűjtemény
- PAT – Az innovatív gyógyszeripari fejlesztés, gyártás és minőségbiztosítás keretrendszere (angol)
- Extrúzió
- Gyógyszeripari ömledékextrúzió (angol)
- Szuperkritikus fluidumok (angol)
- Elektrosztatikus szálképzés
- Transzmissziós Raman-spektroszkópia
- Transzmissziós Raman-spektroszkópia (angol)
Hivatkozások listája
[1] M. Birch, S.J. Fussell, P.D. Higginson, N. McDowall, I. Marziano, Towards a PAT-Based Strategy for Crystallization Development, Org. Process Res. Dev. 9 (2005) 360–364.
[2] S. Ferguson, G. Morris, H. Hao, M. Barrett, B. Glennon, Characterization of the anti-solvent batch, plug flow and MSMPR crystallization of benzoic acid, Chem. Eng. Sci. 104 (2013) 44–54.
[3] L. Abboud, S. Hensley, Wall Street Journal, New Prescription for Drug Makers: Update the Plants (2003) 2003. 09. 03, Dow Jones & Company, New York. Lementve: 2014. 06. 29.
[4] A.S. Rathore, H. Winkle, Quality by design for biopharmaceuticals., Nat. Biotechnol. 27 (2009) 26–34.
[5] U.S. Department of Health and Human Services, Food and Drug Administration, Guidance for industry: PAT – a framework for innovative pharmaceutical development, manufacturing, and quality assurance, (2004). http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm070246.pdf Lementve: 2014. 06. 29.
[6] S. Bosselmann, R.O. Williams III, Route Specific Challenges in the Delivery of Poorly Water-Soluble Drugs, In: R. O. Williams III, A.B. Watts, D.A. Miller (eds.) Formulating Poorly Water Soluble Drugs p3, Springer, New York (2012) ISBN: 978-1-4614-1143-7
[7] https://www.ices.a-star.edu.sg/media/30880/5-Melt-Extruded-Oral-Controlled-Release-Systems.pdf Lementve: 2014. 06. 29.
[8] J. Breitenbach, Melt Extrusion Can Bring New Benefits to HIV Therapy: The Example of Kaletra Tablets, Am. J. Drug Deliv. 4 (2006) 61–64
