|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME VBK / Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Hornyánszky Gábor
Számításos és kísérletes enzimmérnökség
A kutatási téma néhány soros bemutatása
Szerves kémiai vegyületek előállításának egy aránylag új tudományterülete az izolált enzimek vagy főleg mikroorganizmusok (gombák, baktériumok) szintetikus eljárásokra való felhasználása, átfogó nevén fehér biotechnológia. Ezen szintézisek előnyei, hogy szelektívek (melléktermékek keletkezése visszaszorul), fenntarthatóak, környezetkímélők, gazdaságosak lehetnek, és veszélyes anyagok keletkezését is elkerülhetjük a folyamatok során. Munkám során számításos módszereket használtam és fejlesztettem, hogy az enzimekkel kapcsolatos kísérleti munkát támogassam, annak mennyiségét csökkentsem, ezzel is hatékonyabbá, környezetbarátabbá tegyem az enzimes folyamatokat, és azoknak a fejlesztését is.
A kutatóhely rövid bemutatása
A BME Szerves Kémiai és Technológia Tanszékén működő Bioorganikus Kémiai Kutatócsoport célja enzimek kutatása, tervezése, alkalmazási lehetőségeinek vizsgálata és kiterjesztése a szerves kémiai szintézisekben. Az alapkutatásokon felül fejlesztő munkát is végzünk, főleg enzimek rögzítésével és folyamatos üzemű reaktorokban való alkalmazásaival akadémiai (Enzimológiai Intézet, KKKI, BBTE) és ipari partnerekkel (Fermentia) karöltve.
A kutatás történetének, tágabb kontextusának bemutatása
Az enzimek olyan fehérjék, melyek szervezetekben lejátszódó kémiai folyamatoknak a katalizátorai. Az enzimek katalitikus hatását már az ókorban is hasznosították élelmiszerek előállítására, de ipari méretű felhasználásuk csak a múlt évszázad közepén indult meg – egyik legékesebb példája a penicillin előállítása. Ez a biokémiát, mikrobiológiát és a mérnöki tudományokat egymásba olvasztó diszciplína korunk egyik legdinamikusabban fejlődő tudományterülete, mely felhasználásra talált a gyógyszeriparban, a mezőgazdaságban és a környezetvédelemben is.
Az enzimek legnagyobb erőssége, hogy királis vegyületek előállítására képesek. Egy vegyületet akkor nevezünk királisnak, ha léteznek olyan módosulatai, amik összetételben, az atomok kapcsolódásában megegyeznek, mégsem hozhatóak teljesen fedésbe egymással,
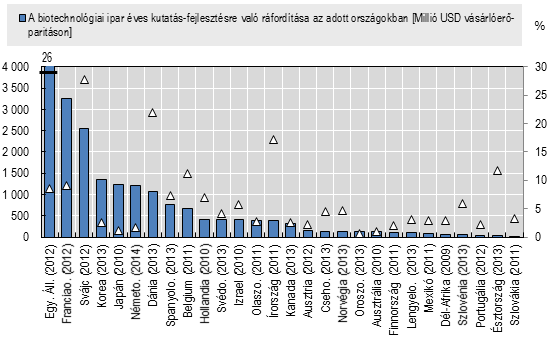
-
ábra Országok ráfordításai a biotechnológiai ipa kutatás-fejlesztésére ( millióUSD, vásárló erő paritáson számolva)
kvázi tükörképei egymásnak (mint amilyen az emberi kéz). A tükörképi párokat enantiomereknek hívjuk, az elrendeződésüket konfigurációnak. Mivel a gyógyszerhatóanyagok egy számottevő része királis vegyület, és megfelelő gyógyhatása sokszor csak az egyik enantiomernek van, ezért rendkívül fontos a kevésbé hatásos, vagy rosszabb esetben toxikusabb, izomer mellőzése. Ezzel kapcsolatos a hírhedt Contergan botrány, amikor az említett gyógyszer hatóanyaga királis volt, és sajnos a nyugtató hatású (R)-thalidomid mellett az (S)-thalidomid magzatkárosító hatású. Az eset után szigorítottak a gyógyszerek és vizsgálataik előírásain.
További előnyeik az enzimeknek, hogy enyhe reakciókörülmények között működnek, és fehérjék lévén az előállításuktól kezdve lebomlásukig természetes anyagokat igényelnek és eredményeznek, és önmagukban is használhatóak gyógyszerként, mint biomedicina.
2. ábra Kiralitás illusztrációja
A kutatás célja, a megválaszolandó kérdések.
A kutatócsoportban végzett munkámat fel lehet osztani alapkutatásra, számításos módszerek fejlesztésére, enzimatikus módszerek fejlesztésére (ami nagyrészt lefedi az enzimmérnökség tárgykörét), és szerves preparatív kémiára. Egyik fő célom a kísérleti munka mennyiségének csökkentése racionális enzimtervezéssel, kísérletek tervezésével és értékelésével. Fontos szempont volt, hogy a csoport többi tagjával szoros együttműködésben dolgozzak, ezért igyekeztem több tudományterületet megismerni, használni, melyek integrálásával hatékonyabbá tehetem a munkát.
Az enzimatikus folyamatok legfontosabb kérdései, hogy milyen az adott enzim szerkezete, milyenek szerkezeti sajátságai, milyen kölcsönhatásokat is alakít ki az aktuális molekulánkkal, és mi is a pontos mechanizmusa a reakciónak. A kísérleti tapasztalatokkal és a modellezés eredményeivel végül belekezdhetünk az enzimek tulajdonságainak manipulálásába. Az enzimeket gyakran nem a természetes szubsztrátjukkal visszük reakcióba, ezért a hasonló, de nem azonos molekula az aktív centrum módosítását követeli a megfelelő affinitás, és aktivitás eléréséhez. Továbbá királis vegyületek esetén külön figyelmet kell szentelni a megfelelő enantiomer szelektivitására. További problémát jelenthet, hogy az enzimek gyakran érzékenyek lehetnek a hőmérséklet- és pH-változásra, amit inaktiválódás követ. Az inaktiválódás menetének és gyenge pontjainak pontos ismerete lehetőséget ad a probléma megoldására.
![]()
3. ábra Enzimmérnökség illusztrációja
Módszerek
Kémiai reakciók atomi szintű modellezése számításigényes feladat, ami csak nagyobb teljesítményű számítógéppel és speciális szoftverekkel történhet. Mivel célunk a kísérleti munka támogatása volt, a felhasznált módszerek nagyon szerteágazóak, alárendelve magukat az aktuális fizikai probléma megoldásának, így csak nagy vonalakban van lehetőségem ismertetni őket.
A kvantumkémiai módszerek (QM) a kvantummechanika egyenleteinek közelítő megoldásán alapulnak, ami rengeteg molekuláris tulajdonság modellezésére ad lehetőséget, ám számításigényes, ezért aránylag kis számú atom számolására alkalmas. Az általunk számolt főbb tulajdonságok a savasság, ionizációs energia, a használt szoftverek a Gaussian és az MRCC voltak.
A molekulamechanika (MM) a molekulamodellezés klasszikus mechanikán alapuló módszere, ami főleg nagyméretű rendszerek (például a több tízezer atomot tartalmazó biomolekulák) modellezésére, szimulációjára használatos. Kedveltségének fő oka, hogy nagyságrendekkel kisebb számításigényű, mint a kvantumkémiai módszerek, és így nagy méretű rendszerek is kezelhetőek vele. Az enzimek szerkezetének, és azok kis molekulákkal létrehozott kölcsönhatásainak kezelése ezzel a módszerrel történt. A felhasznált szoftver a Schrödinger Suite volt.
Az előző két módszer ötvözetei a QM/MM módszerek, ami egy nagyobb rendszer QM és MM részre való osztását jelenti, ahol a kémiai reakció leírása QM, a környezet leírása MM módszerrel történik. Előnye, hogy enzimek reakciómechanizmusának részletes modellezése is lehetséges.
Amennyiben nem áll kísérletesen meghatározott enzimszerkezet a rendelkezésünkre, akkor homológiamodellezéssel kaptam szerkezeti modellt. Ezen módszer lényege, hogy egy ismeretlen szerkezetű enzimet, egy hasonló aminosav szekvenciájú, de szerkezettel is rendelkező alapján készítek el. Ha a szekvenciaazonosság megfelelően nagy (>30%), akkor általában jól működik az eljárás. A használt szoftver a MODELLER volt.
Adatok elemzésekor paraméteres, nem-paraméteres és feltáró statisztikai módszereket használtam a Statistica szoftverrel.
Eddigi eredmények
Fenilalanin ammónia-liázok
A fenilalanin ammónia-liázok élő szervezetekben a fenilalanin lebontását végzik. QM/MM számítások azt mutatták, hogy az irodalomban leírt háromféle reakciómechanizmus közül az N-MIO intermedieren keresztüli mechanizmus a reális csak [A]. Vizek Monte-Carlo-modellezése azt mutatta, hogy az aktív centrumban a katalitikus bázis Tyr110 közvetlen közelében víz található, amit egy homológ enzim esetében deutériumizotópos vizsgálat is alátámaszt. Kutatócsoportunkban több, racém aromás aminosavat állítottunk elő, és vizsgáltuk a petrezselyemből származó említett enzimmel.
Sztirilalaninok esetében megfigyeltük, hogy a reakció lassú, és gyenge az enantioszelektivitás. A számítások azt mutatták, hogy a lassú reakció a csökkent affinitás következménye, ami a komoly térbeli ütközések miatt van. Ráadásul ennek mértéke nagyjából ugyanannyi mindkét enatiomerre, ami a szelektivitást csökkenti. Egy aminosav cserélésével (Phe137Val) mutáns enzimet hoztunk létre, amivel ezerszeres reakciósebesség-növekményt tudtunk elérni, miközben már csak az egyik enatiomer alakult át. Az ok, hogy sikerült szelektíven az egyik enantiomer kedvezőtlen ütközéseit az enzimben csökkenteni.
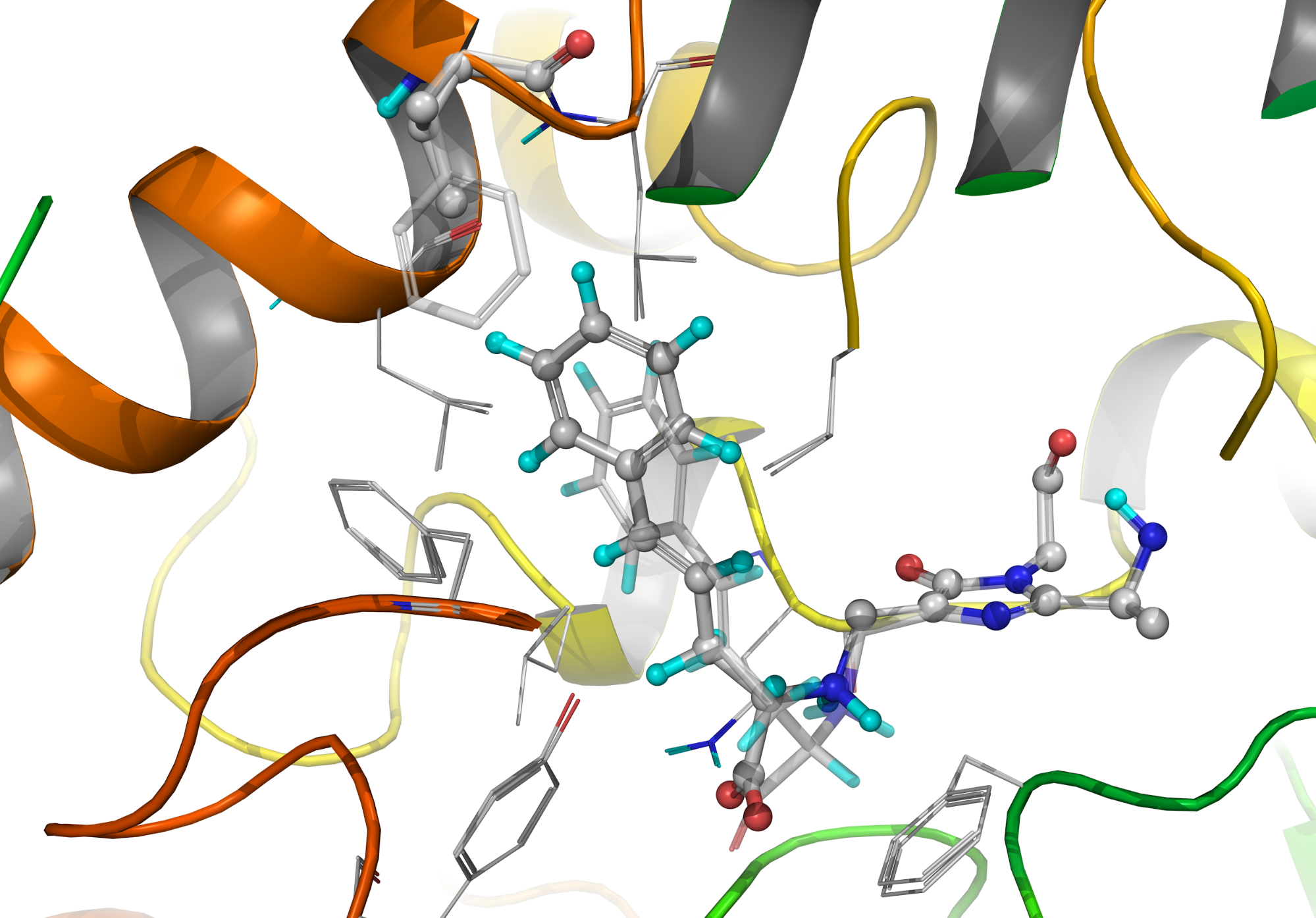
4. ábra Sztirilalanin orientációja vad típusú és Phe137Val mutáns enzimben
Benzofurán-2-ilalanin származékok vizsgálatakor kiderült, hogy a 7-es helyzetben szubsztituált (módosított) vegyületek nem alakulnak át, még a Phe137Val mutáns enzimmel sem. Modellezés során kiderült, hogy a katalitikusan aktív állapot nem tud létrejönni, mert egy inaktív állapot az energetikailag legkedvezőbb elrendeződés.
Fenilalanin ammónia-liázok hőstabilitásának vizsgálatakor homológia modellezéssel több enzim szerkezetét meghatároztam, amelyek az irodalomban fellelhető enzimkinetikai paraméterekkel rendelkeznek. Megállapítottam, hogy a sóhidak számának szignifikáns hatása van a hőstabilitásra, míg a diszulfid hidaknak nincs, ami felveti az enzimek előállítási módjának felülvizsgálatát [B,C,D].
Fenilalanin aminomutázok
A fenilalanin aminomutázok
![]() - és
- és
![]() -fenilalanin egymásba alakulását katalizálják. QM/MM számítások és röntgenkrisztallográfiai adatok azt mutatták, hogy az aktív centrumban egy glutaminsav oldallánca az irodalomban leírtakkal szemben protonált állapotban van jelen a szubsztráttal együtt. Vizek Monte-Carlo-szimulációja azt mutatta, hogy a petrezselyem fenilalanin ammónia-liázzal ellentétben az aktív centrumból teljesen kiszorul a víz.
-fenilalanin egymásba alakulását katalizálják. QM/MM számítások és röntgenkrisztallográfiai adatok azt mutatták, hogy az aktív centrumban egy glutaminsav oldallánca az irodalomban leírtakkal szemben protonált állapotban van jelen a szubsztráttal együtt. Vizek Monte-Carlo-szimulációja azt mutatta, hogy a petrezselyem fenilalanin ammónia-liázzal ellentétben az aktív centrumból teljesen kiszorul a víz.
Kutatócsoportunkban több racém aromás aminosavat szintetizáltunk, és vizsgáltuk Pantoea agglomerans-ból származó fenilalanin aminomutázzal. A kísérleti tapasztalatok azt mutatják, hogy orto szubsztituált vegyületek közül általában csak a
![]() -izomer reagál, meta és para szubsztituált molekulák esetén viszont általában csak az
-izomer reagál, meta és para szubsztituált molekulák esetén viszont általában csak az
![]() . A számításos eredmények azt mutatták, hogy a katalitikusan aktív
. A számításos eredmények azt mutatták, hogy a katalitikusan aktív
![]() és
és
![]() állapotok energiakülönbsége az egyik legmeghatározóbb tényező a folyamat szempontjából, amit a meta szubsztituált
állapotok energiakülönbsége az egyik legmeghatározóbb tényező a folyamat szempontjából, amit a meta szubsztituált
![]() - vegyületek esetén még egy energetikailag kedvező inaktív állapot is tovább ront [E].
- vegyületek esetén még egy energetikailag kedvező inaktív állapot is tovább ront [E].
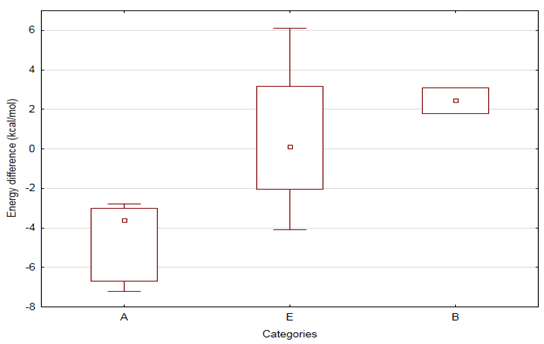
5. ábra A vegyületek 3 kategóriába sorolása az
![]() és
és
![]() izomereik konverziókülönbsége alapján világosan mutatja, hogy szélsőséges esetben (A és B kategória) az
izomereik konverziókülönbsége alapján világosan mutatja, hogy szélsőséges esetben (A és B kategória) az
![]() és
és
![]() állapotok energiakülönbsége szignifikánsan eltér és előjelet is vált.
állapotok energiakülönbsége szignifikánsan eltér és előjelet is vált.
Candida antarctica lipáz B
Lipáz enzimek a természetben trigliceridek hidrolízisét katalizálják. Biotechnológiai haszna ezen enzimeknek a kinetikus rezolválásban rejlik, amivel enantiomereket lehet szétválasztani. Kutatócsoportunkban sikerült különböző adalékanyaggal bioimprinting effektussal rögzíteni többek közt a Candida antarctica lipáz B (CalB) enzimet. Az ez évben publikált nyílt és zárt állású CalB szerkezet vizsgálatával kiderült, hogy egyes adalékanyagok esetében nem csak az aktív centrum kitöltésével, hanem a nyílt/zárt formáért felelős hurokkal való kölcsönhatásukkal magyarázhatóak a kiugróan jó eredményeik [F].
Kettő, általam előállított és további 6 heterociklusos szekunder alkohol modellezése során kiderült, hogy a nyílt és zárt forma ellenkező sztereospecifikussággal rendelkezik, ezért a kérdés eldöntésére a termék kinyerése, és abszolút konfigurációjának meghatározása elengedhetetlen [G].
Várható impakt, további kutatás
Az érintett témákban mostanra sikerült a szükséges tudást felhalmozni, hogy megfelelő szinten érthessük a biokatalitikus folyamatokat. Terveinkben szerepel enzimek konkrét vegyületekre szabása mindhárom említett enzimcsalád esetében. Az anyagi támogatást ehhez az aktuálisan elnyert Competitiveness Operational Programme 2014-2020 (Action 1.1.4) európai uniós pályázat biztosítja. Továbbá részletes kinetikai vizsgálatot tervezünk QM/MM módszerrel.
Saját publikációk, hivatkozások, linkgyűjtemény
[A] Phenylalanine Ammonia-Lyase-Catalyzed Deamination of an Acyclic Amino Acid: Enzyme Mechanistic Studies Aided by a Novel Microreactor Filled with Magnetic Nanoparticles, Diána Weiser, László Csaba Bence, Gergely Bánóczi, Ferenc Ender, Róbert Kiss, Eszter Kókai, András Szilágyi, Beáta G. Vértessy, Ödön Farkas, Csaba Paizs, László Poppe, ChemBioChem, 2015, 16(16), 2283–2288, IF: 3.088
[B] Molecular modeling in biotechnology, Gergely Bánóczi, Klaudia Kovács, Gábor Hornyánszky,Beáta G Vértessy, László Poppe, Proceeding of the PhD Conferences organised by the Doctoral Schools of the BME, in the framework of TÁMOP-4.2.2/B-10/1-2010-0009 2012, IF:-
[C] Expression and properties of the highly alkalophilic phenylalanine ammonia-lyase of thermophilic Rubrobacter xylanophilus, Klaudia Kovács, Gergely Bánóczi, Andrea Varga, Izabella Szabó, András Holczinger, Gábor Hornyánszky, Imre Zagyva, Csaba Paizs, Beáta G. Vértessy, László Poppe, PLOS-ONE, 2014, 9(1), e85943, IF:3.730
[D] Structural modeling of phenylalanine ammonia-lyases and related MIO-containing enzymes – an insight into thermostability and ionic interactions, Gergely Bánóczi, Csongor Szabó, Zsófia Bata, Gábor Hornyánszky, László Poppe, STUDIA UBB CHEMIA, 2015, 60(4), 213–228, IF: 0,136
[E] Influence of the aromatic moiety in α- and β-arylalanines on their biotransformation with phenylalanine 2,3-aminomutase from Pantoea agglomerans, Andrea Varga, Gergely Bánóczi, Botond Nagy, László Csaba Bencze, Monica Ioana-Toşa, Ákos Gellért, Florin Dan Irimie, János Rétey, László Poppe, Csaba Paizs, RSC Adv., 2016,6, 56412–56420, IF: 3.289
[F] Bioimprinted lipases in PVA nanofibers as efficient immobilized biocatalysts, Diána Weiser,
Péter L. Sóti, Gergely Bánóczi, Viktória Bódai, Bálint Kiss, Ákos Gellért, Zsombor K. Nagy, Béla Koczka, András Szilágyi, György Marosi, László Poppe, Tetrahedron, 2016, in press, IF: 2.645
[G] Lipase-catalysed kinetic resolutions of racemic 1-(10-ethyl-10-H-phenothiazin-1,2 and 4-yl)ethanols and their acetates, Jürgen Brem, Sarolta Pilbák, Csaba Paizs, Gergely Bánóczi, Florin-Dan Irimie, Monica-Ioana Toşa, László Poppe, 2011, Tetrahedron Asymmetry., 22 (8), 916-923. IF: 2,165
Linkgyűjtemény.
