|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME VBK / Szervetlen és Analitikai Kémia Tanszék
Témavezető: Dr. Csonka Gábor István
Biomolekulák 3D kvantumkémiai modellezése
A kutatási téma néhány soros bemutatása
Doktori kutatásom célja a háromdimenziós elektronsűrűségen alapuló elméleti kémiai módszerek (sűrűségfunkcionálok) fejlesztése és alkalmazása biomolekulák térszerkezetének és gyenge kölcsönhatásainak vizsgálatára. Pályázatomban az általam korábban kifejlesztett nagypontosságú módszert alkalmazom két biológiailag rendkívül fontos felismerési folyamatban: az immunfelismerésben és az epigenetikai felismerésben.
A kutatóhely rövid bemutatása
A BME Szervetlen és Analitikai Kémia Tanszékén sok évtizede folyik elméleti kémiai kutatás több kutatócsoportban. A tanszékről sok jelentős eredményt elérő kutató és oktató került ki. Témavezetőmnek több kiemelkedően idézett (ún. ISI citation classic) publikációja van az elméleti fizikai kémia [1-9] területén (a legidézettebb 1800 hivatkozás feletti). Kiterjedt nemzetközi kapcsolatokkal rendelkezik, a Tulane University és a Temple University amerikai egyetemeken külső meghívott kutató.
A kutatás történetének, tágabb kontextusának bemutatása
Kutatásom alapját témavezetőm Csizmadia Imre professzorral 1995-ben közösen kezdett kutatása adja, melyben szacharidok és glikopeptidek potenciálisenergia-hiperfelületét vizsgálták számításos kémiai módszerekkel. A számított cukor konformerek geometriáit és energiáit belevették az egyik legismertebb kvantumkémiai tesztadatbázisba (GMTKN30) az SCONF tesztsorként.
Az MSc hallgatóként kezdett kutatómunkámból írt TDK dolgozattal intézményi TDK I. helyezés értem el. A PhD munkám során a kutatást kiterjesztettük egy másik biológiailag jelentős folyamatra is, melyben a metilezett DNS epigenetikai felismerése történik különböző fehérjék által. A téma horderejét érzékelteti, hogy 2015-ben 32 oldalas, 95 szerzős cikk jelent meg a teljes humán epigenom analízisével kapcsolatban a Nature-ben.
Napjainkra a számítástechnika olyan fejlettségi szintre ért el, hogy a nagyobb méretű biológia rendszerek pontos kvantummechanikai számítása is kezd elérhetővé válni. Ehhez kapcsolódik az általam kifejlesztett dRPA75 módszer is, mellyel nagy pontossággal és hatékonyan lehet számítani akár 100 főcsoporti elemből álló rendszer kölcsönhatási energiáját is.
A kutatás célja, a megválaszolandó kérdések
O-glikoziláció az immunfelismerésben
A fehérjék szerkezetét és kölcsönhatásait az aminosav-szekvenciájukon felül a poszt-transzlációs módosítások is befolyásolják. A szerin vagy treonin aminosavak oldalláncában lévő oxigén atomhoz kapcsolt cukoregységeket nevezzük O-glikozilációnak. Ilyen fehérjemódosítások vannak a rákos sejtekben jelen lévő Tn antigénben is. Az egészséges sejtekben ezzel szemben az immunrendszernek van antitestje a Tn antigén ellen, amely képes elnyomni a Tn antigén termelődését. Az immunfelismerésben feltehetően a fehérje felületén lévő cukorantenna kódolja az információt. Érdekes kérdések, hogy milyen cukoregységek kötődhetnek a fehérje felületéhez, milyen orientációban, és a cukorantenna hogyan befolyásolja a fehérje szerkezetét?
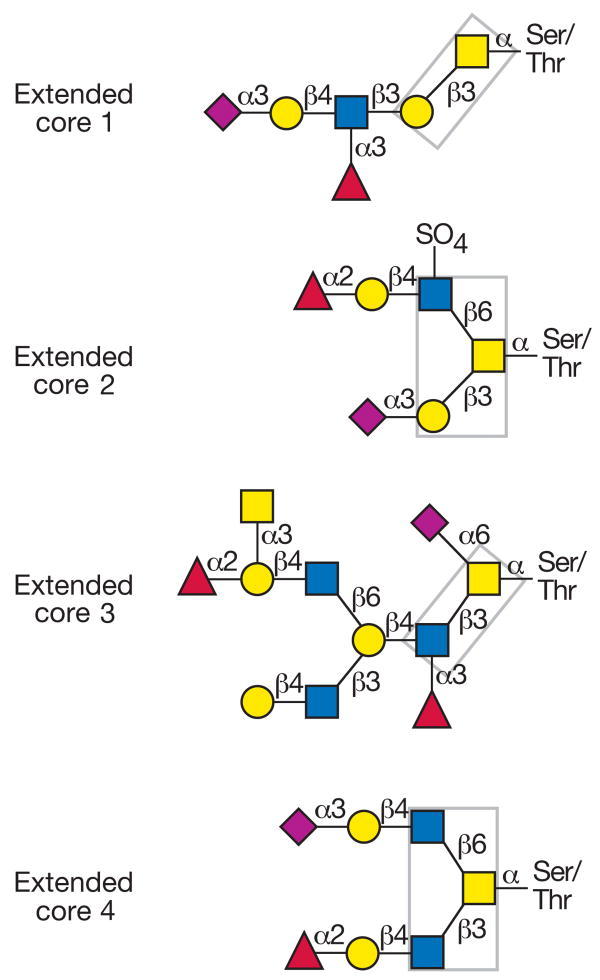
1. ábra O-glikozidos cukorantenna lehetséges magszerkezetei
(sárga kör = galaktóz; sárga négyzet = N-acetilgalaktózamin; kék négyzet = N-acetilglükózamin; lila rombusz = N-acetilneuraminsav; vörös háromszög = fukóz)
DNS-metilezettség az epigenetikai felismerésben
A genetikai információn felül a DNS tartalmaz a gének kifejeződését szabályozó epigenetikai információt is. Ezt az információt a leggyakrabban a gének promóter régiójában lévő palindrom citidin-foszfát-guanozin dinukleotid (CpG) motívumok a citozinokon történő szimmetrikus metilezése szolgáltatja. Ez megváltoztatja a DNS nagy árok-kölcsönhatási felületét, melynek hatására a metilezett DNS-hez metil-CpG-kötő domén (MBD) fehérjék kötődnek, és ez transzkripciós represszióhoz vezet. A DNS szintézis során és később a környezeti hatásokra létrejövő DNS hibák visszaszorítására a szervezetnek különféle hibajavító mechanizmusai vannak. A DNS metilezettség mintázatának megváltozása a tumor elnyomó gének transzkripciós gátlását is okozhatja, mely rákhoz vezethet. Érdekes kérdések, hogy milyen kölcsönhatások szabják meg a metil-DNS felismerését, és milyen mechanizmus szerint történik a felismerés?
2. ábra Szimmetrikusan metilezett CpG motívum a DNS-ben
Módszerek
Sűrűségfunkcionál elmélet
A sűrűségfunkcionál elmélet [10] lényege, hogy egy egzakt effektív potenciállal, hipotetikus nem kölcsönható rendszerként kezeli a fizikai kölcsönható rendszereket. Az elmélet hatékony, mert a számításokhoz a sokelektronos rendszer leírására könnyebben kezelhető egyelektronos pályákat használunk. A hipotetikus rendszer a fizikaival megegyező elektronsűrűségre vezet, és megadja az egzakt elektronenergiát. A dolog egyetlen “szépséghibája”, hogy az effektív potenciál univerzális alakja ismeretlen, ezért az elmélet alkalmazása során közelítésekre van szükség.
Sűrűségfunkcionál közelítések
A sűrűségfunkcionál közelítések [11] között a legalacsonyabb szintű közelítés homogén elektrongázként kezeli a fizikai rendszerek nemhomogén elektronsűrűségét. Ez a lassan változó elektronsűrűségű fémrácsoknál jó közelítés, azonban a gyorsan változó elektronsűrűségű atomoknál és molekuláknál az elektronsűrűség változását is figyelembe vevő korrekciókra van szükség. A molekulák közötti hosszútávú gyenge kölcsönhatások leírása még sokkal nagyobb kihívás, mivel e kölcsönhatások tisztán nemlokális természetűek, így nem elegendő az elektronsűrűség lokális ismerete.
Saját módszer gyenge kölcsönhatásokra
Az általam kifejlesztett dRPA75 módszer [S4] hatékonyan képes figyelembe venni a nemlokális természetű kölcsönhatásokat. Nagy pontosságú energiákat (0,2-0,5 kcal/mol pontosság) szolgáltat a biomolekulákon belüli (intramolekuláris) és ezek közötti (intermolekuláris) gyenge kölcsönhatásokra. Jól teljesít továbbá szerves kémiai reakciók energiájára és aktiválási energiájára is. Az általam kifejlesztett módszer hatékonyan beprogramozható.[12, 13]
Egyéb felhasznált módszerek
A kölcsönhatási energia hozzávetőleges számítására másodrendű perturbációs MP2 módszert alkalmaztam. A molekulageometriák gyors optimálására szemi-lokális M06L sűrűségfunkcionál módszert alkalmaztam. A pontosabb frekvenciaszámítás érdekében a termokémiai számításoknál a geometriákat hibrid B3LYP sűrűségfunkcionál módszerrel optimáltam. A számításokhoz különböző háromszorosan felhasított vegyérték bázisokat alkalmaztam.
Eddigi eredmények
Intramolekuláris kölcsönhatások az immunfelismerésben
Az O-glikozidos kapcsolat szerkezetét és energetikáját α és β N-acetilgalaktózaminnal és N-acetilmannózaminnal szubsztituált szerin glikopeptid modell szerkezetek segítségével vizsgáltam. A korábbi gázfázisú modell-szerkezetek alapján az N-acetilgalaktózamin cukoregységen lévő hidrogénkötés-mintázat képes az acetamido csoport rögzítésére, amennyiben az (O3)H csoport az O7 atommal alakít ki hidrogénkötést. Kimutattam azonban, hogy egy hasonló energiájú elrendeződésben, amikor az (O4)H csoport az O6 atommal alakít ki hidrogénkötést, az (O3)H csoport el tud fordulni az O4 atom felé is, így szabaddá téve az acetamido csoport rotációját. Továbbá a rotáció akkor is megengedett, ha az (O3)H csoport szubsztituálva van a cukorantennában.
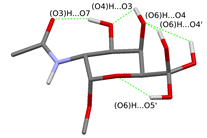
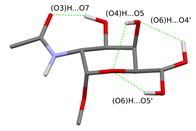
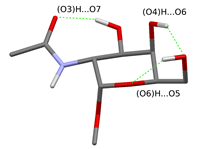
1. ábra Acetamido csoportot rögzítő lehetséges hidrogénkötés mintázatok a cukoregységen
(A kizárólag az (O6)H csoport orientációjában különböző rotációs izomereket egy ábrán belül ábrázoltam.)
A korábbi gázfázisú szerkezetek alapján feltételezték, hogy a cukoregységen lévő acetamido csoport közvetlenül kapcsolódik a peptid gerinchez, így merevítve a glikopeptid kapcsolat szerkezetét. Kimutattam azonban, hogy egy vízmolekulát adva a rendszerhez, a szerkezeti vízmolekula áthidalásként képes beépülni a cukoregység elfordulni képes acetamido csoportja és a peptid gerinc közé. Ez lehetővé teszi a peptid gerincet merevítő hidrogénkötés felszakadását és a peptid lánc által preferált γ-kanyar másodlagos szerkezet megváltozását.
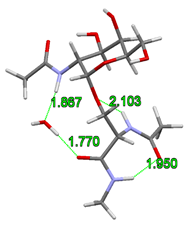
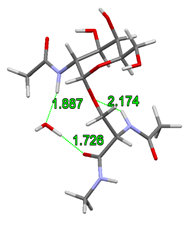
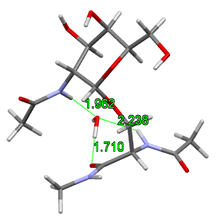
2. ábra Szerkezeti víz beépülése a glikopeptid kapcsolatba
A gázfázisú szerkezetek alapján a glikopeptid kapcsolat merevsége az α izomereknél, és azon belül is az N-acetilgalaktózaminnál bizonyult a legnagyobbnak. Kimutattam továbbá, hogy a korábban feltételezett γ-kanyar másodlagos szerkezet helyett a szerkezeti vízmolekula beépülése lehetővé teszi a poliprolin II hélix és antiparallel β-láncok másodlagos szerkezetek kialakulását is. A számított torziós szögek jobban egyeznek a kísérletileg meghatározott torziós szögekkel. Ezek szélesebb tartományon belüli változása, valamint a cukorantenna nagy térkitöltése együttesen jobban összhangban van a kísérletileg tapasztalt random hurkok kialakulásával.
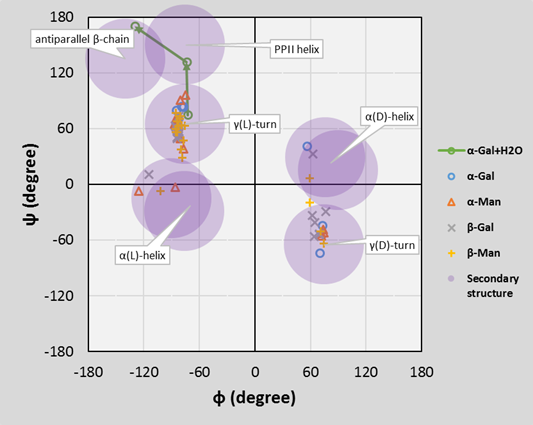
3. ábra Ramachandran diagram az O-glikopeptid gerincre
Intermolekuláris kölcsönhatások az epigenetikai felismerésben
A metil-DNS és MBD fehérjék közötti kölcsönhatásokat először két kisebb arginin-guanin-metilcitozin modell-triád segítségével vizsgáltam. A tapasztalt kölcsönhatástípusok: hidrogénkötés az arginin és guanin között; kation-π kölcsönhatás a metilcitozin és az arginin között; és diszperziós kölcsönhatás a metilcitozin metilcsoportja és az arginin oldallánca között. E kölcsönhatások erőssége a geometria-optimálás során rendre az arginin oldallánc, a DNS nagyárok és a fehérje peptid gerinc flexibilitásának növelésével növekedett. A kölcsönhatás számított erőssége: -42-43 kcal/mol triádonként. Ebből egy metilcsoport hatása -1-2 kcal/mol stabilizációt jelent, mely jelentősebb az arginin 44 esetében.
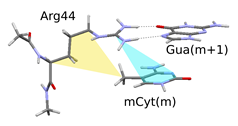
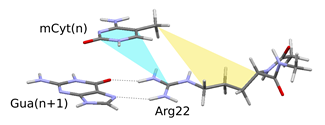
4. ábra Lehetséges kölcsönhatások a metilezett DNS és az MBD fehérje között
A szobahőmérsékleten vett termokémiai számításokra egy nagyobb modellt használtam, mely két metilcsoportokkal lezárt arginin oldallánc fejcsoportot, egy aszpartát oldalláncot és két-két citozin és guanin bázist tartalmazott. A különböző számú szerkezeti vízmolekulával számított modellek egyaránt -42 kcal/mol szabadentalpia változást mutattak. A számított kölcsönhatásban a nagy negatív entropikus tag dominál, mely a hidrofób kölcsönhatás központi szerepére utal.
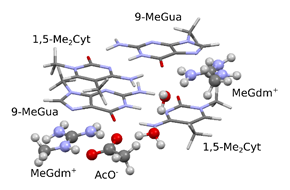
5. ábra Modell a metil-CpG motívum és az MBD fehérje közötti kölcsönhatásra
Az MBD fehérje oldalláncainak merev helikális rotációja a DNS kettős hélix tengelye mentén azt mutatja, hogy a fehérje esetleges elcsúszása során az arginin oldalláncok fejcsoportja különböző mértékben kerülne közel a guanidinium csoportok síkja felett, illetve alatt lévő szomszédos metilcitozin metilcsoportokhoz. Az ábrázolásból kitűnik, hogy az arginin 22 oldallánc sztérikusan gátolja a fehérje elcsúszását az egyik irányba, mivel az aszpartát oldallánc hidrogénkötésekkel rögzíti, és gátolja az elfordulását (lezárt állapot). Ugyanakkor az arginin 44 oldallánc csak akkor gátolja sztérikusan az elcsúszást a másik irányba, ha a guaninnal két hidrogénkötést alakít ki (nyitott/zárt állapotok). Ez a megállapítás összhangban van az MBD4 fehérjénél kísérletileg tapasztalt "pattogó" kereső mechanizmussal.
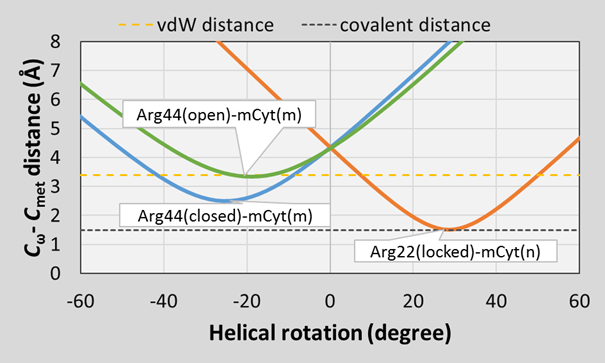
6. ábra Sztérikus gátlások az MBD fehérje a DNS kettős hélixen való helikális rotációjára
Várható impakt, további kutatás
Saját cikkeim közül [S1-8] négy jelent már meg az elméleti kémia tudományterületen az első 10%-ba tartozó Journal of Chemical Theory and Computation folyóiratban. A tavalyi év őszén, doktori munkám elismeréseként Kutatói Ösztöndíjas állást kaptam az amerikai Temple University Center for Materials Theory intézetében.
Az általam kifejlesztett dRPA75 elméleti módszer kiválóan teljesít a molekuláris fizikai kémia számos területén. Ezt jól érzékelteti az a tény is, hogy módszeremet már rövid idővel a kifejlesztése után az MRCC kvantumkémiai szoftverben implementálták.
Az O-glikoziláció fehérjeszerkezetet befolyásoló hatására kidolgozott modellem az eddigi modelleknél jobban összhangban van a glikoproteinek lokális és globális szerkezetére vonatkozó kísérleti tapasztalatokkal.
A metil-CpG motívum és az MBD fehérjék kölcsönhatási felületére kidolgozott modellem pedig alapjául szolgálhat a metil-DNS felismerés mechanizmusának alaposabb megértéséhez.
Saját publikációk, hivatkozások, linkgyűjtemény
Saját publikációim:
[S1] Mezei, P. D.; Csonka, G. I.; Ruzsinszky, A.; Sun, J. J. Chem. Theory Comput. 2015,
11, 360–371. (IF = 5,498, ID = 6)
[S2] Mezei, P. D.; Csonka, G. I.; Kállay, M. J. Chem. Theory Comput. 2015, 11, 2879-2888.
(IF = 5,498, ID =3)
[S3] Mezei, P. D.; Csonka, G. I.; Ruzsinszky, A. J. Chem. Theory Comput. 2015, 11,
3961-3967. (IF = 5,498, ID = 3)
[S4] Mezei, P. D.; Csonka, G. I.; Ruzsinszky, A.; Kállay, M. J. Chem. Theory Comput.
2015, 11, 4615-4626. (IF = 5,498, ID = 6)
[S5] Perdew, J. P.; Sun, J.; Ruzsinszky, A.; Mezei, P. D.; Csonka, G. I. Period. Polytech.
Chem. Eng. 2016, 60, 2-7. (IF = 0,296, ID =2)
[S6] Mezei, P. D.; Csonka, G. I. Struct. Chem. 2015, 26, 1367-1379. (IF = 1,837)
[S7] Mezei, P. D.; Csonka, G. I. Struct. Chem. 2016, STUC-D-16-00037R1 (elfogadva).
(IF = 1,837)
[S8] Mezei, P. D.; Ruzsinszky, A.; Csonka, G. I. J. Chem. Theory Comput. 2016,
ct-2016-00-323c (revízió alatt). (IF = 5,498)
Linkgyűjtemény:
Hivatkozások:
[1] Perdew, J.; Ruzsinszky, A.; Csonka, G. I.; Vydrov, O.; Scuseria, G.; Constantin, L.; Zhou, X.; Burke, K. Phys. Rev. Lett. 2008, 100, 136406.
[2] Ruzsinszky, A.; Csonka, G. I.; Scuseria, G. E. J. Chem. Theory Comput. 2009, 5, 763–769.
[3] Perdew, J. P.; Ruzsinszky, A.; Csonka, G. I.; Constantin, L. A.; Sun, J. Phys. Rev. Lett. 2009, 103, 026403.
[4] Ruzsinszky, A.; Sun, J.; Xiao, B.; Csonka, G. I. J. Chem. Theory Comput. 2012, 8, 2078–2087.
[5] Perdew, J. P.; Ruzsinszky, A.; Tao, J.; Staroverov, V. N.; Scuseria, G. E.; Csonka, G. I. J. Chem. Phys. 2005, 123, 62201.
[6] Steinmann, S. N.; Csonka, G. I.; Corminboeuf, C. J. Chem. Theory Comput. 2009, 5, 2950–2958.
[7] Ruzsinszky, A.; Perdew, J. P.; Csonka, G. I. J. Chem. Theory Comput. 2010, 6, 127–134.
[8] Ruzsinszky, A.; Perdew, J. P.; Csonka, G. I. J. Chem. Phys. 2011, 134, 114110.
[9] Csonka, G. I.; French, A. D.; Johnson, G. P.; Stortz, C. A. J. Chem. Theory Comput. 2009, 5, 679–692.
[10] Kohn, W.; Sham, L. J. Phys. Rev. 1965, 140, A1133–A1138.
[11] Perdew, J. P.; Schmidt, K. AIP Conf. Proc. 2001, 577, 1–20.
[12] Heßelmann, A. Phys. Rev. A 2012, 85, 012517.
[13] Rolik, Z.; Szegedy, L.; Ladjánszki, I.; Ladóczki, B.; Kállay, M. J. Chem. Phys. 2013, 139, 094105.
