|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME VBK / Richter Gedeon Nyrt.
Témavezető: Dr. Balogh György Tibor
Gyógyszer hatóanyagok felszívódásának modellezése az eredeti gyógyszerkutatás szolgálatában
A kutatási téma néhány soros bemutatása
A gyógyszerkutatás célja olyan hatóanyagok felfedezése és előállítása, melyek betegségek gyógyítására vagy megelőzésére alkalmasak, ezzel hozzájárulva az életminőség javításához. A kutatás hosszú és költséges folyamat, ezért fontos, hogy már a kezdeti lépések során törekedjünk a sikeres klinikai kipróbálás esélyének növelésére. A kockázatok csökkentésének és a költséghatékonyság növelésének egyik alapvető eszköze a hatóanyagjelöltek korai fázisú fizikai-kémiai jellemzése. Ennek alapja, hogy a szájon át történő gyógyszeradagolás esetében a hatóanyag a tápcsatornában beoldódik, azon keresztül felszívódik, majd a véráram segítségével a célszövetbe jut, azaz eloszlik a szervezetben [1]. A felszívódás előrejelzésére különböző módszerek állnak rendelkezésre (1. ábra). Doktori munkám során egy nem-sejtes kémiai modellt, a Parallel Artificial Membrane Permeability Assay-t (PAMPA) alkalmaztam hatóanyagok szövetspecifikus felszívódásának, megoszlásának modellezésére, növényi kivonatok komponenseinek vizsgálatára, s a foszfolipidózis kockázatának becslésére.
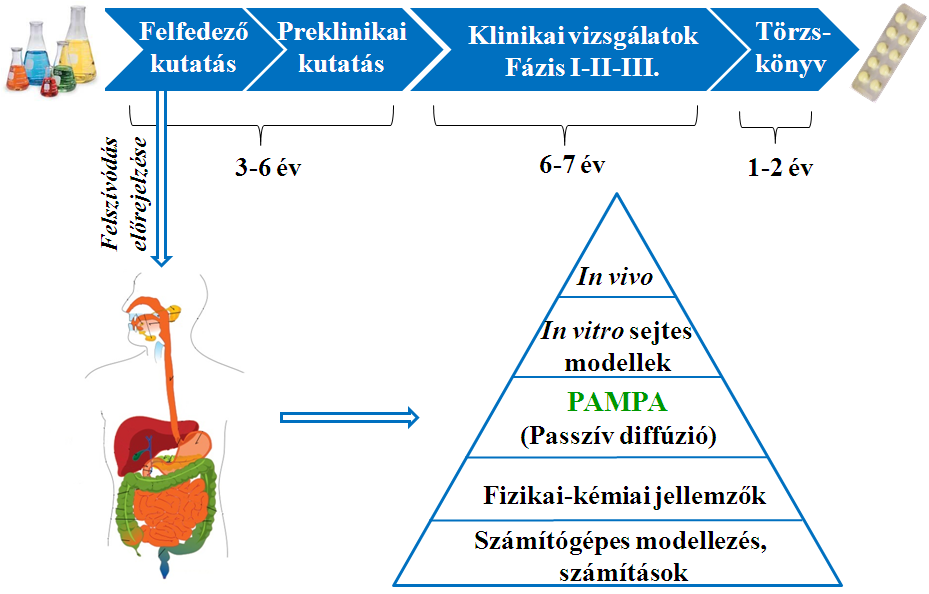
1. ábra. A felszívódás előrejelzésének helye és módszerei a gyógyszerkutatásban
A kutatóhely rövid bemutatása
A Richter Gedeon Nyrt. originális kutatásán kiterjedten 2005 óta folyik a hatóanyagjelöltek fizikai-kémiai jellemzése, illetve folynak alapkutatások ebben a témakörben. Munkám során a Szintézistámogató Laboratóriumban alakult kutatóhely tevékenységéhez csatlakoztam, ahol az új hatóanyagok előállításának analitikai támogatása mellett a gyógyszerjelölt vegyületek főbb, szervezeten belüli sorsát meghatározó fizikai-kémiai paramétereit (ilyenek az oldhatóság, sav/bázis karakter, lipofilitás és permeabilitás) vizsgáljuk.
A kutatás történetének, tágabb kontextusának bemutatása
Az elmúlt két évtizedben a kombinatorikus kémia térhódítása következtében a gyógyszergyárak nagyszámú (akár több millió) molekulát tartalmazó molekulabankokat hoztak létre. Az analitikai módszerek fejlődésének köszönhetően az ipari gyógyszerkutatás gyakorlatában előtérbe került a nagy áteresztőképességű (biológiai aktivitást jelző) szűrőmódszerek (high throughput screening, HTS) alkalmazása. A felgyorsult eredeti gyógyszerkutatás hatására fontossá vált, hogy az aktivitásalapú szűrésen kívül a vegyületek más, kémiai és fizikai-kémiai tulajdonságai is rövid idő alatt, pontosan és költséghatékonyan mérhetőek legyenek. Ezen eredményekből lehet ugyanis következtetni az egyes hatóanyagok szervezetbeli sorsára, azaz előrejelezni azok farmakokinetikai tulajdonságait.
A hatóanyagok fizikai-kémiai jellemzése során többek között arra keressük a választ, hogy a vegyület milyen mértékben fog felszívódni és megoszlani a szervezetben. A gyógyszerek felszívódását és így biohasznosulását elsődlegesen a tápcsatorna bélhámsejtjeinek lipid kettősrétegén történő átjutása határozza meg. A folyamatot leíró elsődleges paraméter a permeabilitás, mely egy vegyület biológiai membránon történő átjutásának sebességét adja meg [1].
Az utóbbi 10–15 évben széles körben elterjedt számos sejtes modell (pl. Caco-2, MDCK) alkalmazása in vitro permeabilitás vizsgálatra [2]. A sejtes modelleknél jóval robusztusabb és olcsóbb a Kansy [3] által 1998-ban kifejlesztett PAMPA rendszer (2. ábra), mely a bélrendszerből történő felszívódást modellezi. Ezt módosította 2003-ban Li Di és csoportja [4], létrehozva egy PAMPA modellt (PAMPA-BBB) a vegyületek vér-agy gáton keresztüli átjutásának becslésére.
A kutatás célja, a megválaszolandó kérdések
A hatóanyagok farmakokinetikai tulajdonságait nagymértékben meghatározza a biológiai belépési kapukon, vagyis az egyes szövetek sejtjeinek lipid kettősrétegén való átjutási képességük. Munkám során célom volt olyan robusztus, költséghatékony és reprodukálható kémiai modellek, módszerek kidolgozása, melyekkel előre lehet jelezni a vegyületek felszívódását és eloszlását. Mivel a különböző szöveteinket, szerveinket különböző felépítésű, lipidösszetételű biológiai membránok határolják, ezeknek megfelelő szövet- és sejtalkotó-specifikus modelleket kívántam létrehozni.
(1) A vegyületek
vér-agy gáton (blood-brain barrier, BBB) keresztüli átjutásának előrejelzésére eddig alkalmazott PAMPA modellek nem egységesek, s nem adnak árnyalt, számszerű adatot az agyi penetráció mértékére. Célom volt a módszer optimálása, finomhangolása, hogy a mérések során pontosabb és árnyaltabb eredményeket nyerhessünk az agyi penetráció lehetőségéről.
(2) A gyógyszerek által kiváltott toxikus hatások közül az egyik legismertebb, több szervet is érintő megjelenési forma a
foszfolipidózis (PLD). Mivel a szakirodalomban eddig nem írtak le pontos és megbízható in vitro modellt a foszfolipidózis előrejelzésére, kutatásunk során felmerült annak a kérdése, hogy a PAMPA módszer alkalmas lehet-e erre.
(3) Az utóbbi években a gyógynövény-alapú gyógyszerkutatás egyre nagyobb hangsúlyt kapott, ezért vizsgálni kívántuk, hogy többkomponensű növényi kivonatok felszívódási tulajdonságainak meghatározására is alkalmas-e a PAMPA rendszer.
Módszerek
A felszívódás vizsgálatára a PAMPA (Parallel Artificial Membrane Permeability Assay) modellt alkalmaztuk. Ez egy szendvics-szerűen elrendezett, 96-lyukú mérőtálca (plate)-alapú módszer (2. ábra).

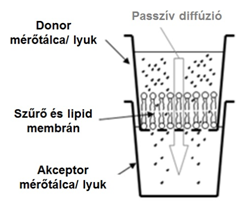
2. ábra. A PAMPA permeabilitási modell
A vizsgálandó hatóanyagokból (melyek forgalomban levő, ismert in vivo felszívódású anyagok) 10 mM-os DMSO-s (dimetilszulfoxidos) törzsoldatokat készítettünk. Ezeket hígítottuk 100-szorosára a donor- (adó-) oldali közeg pH-jának megfelelő pufferrel. Az oldatokat rázattuk, majd szűrtük. Az akceptor- (fogadó-) oldali mérőtálcát a célszövet pH-jának megfelelő pufferrel töltöttük fel (300 μl). Erre helyeztük a donoroldali plate-et. A plate szűrőfelületére vittük fel az általunk készített mesterséges membránt (5-5 μl-t): foszfatidilkolint vagy más foszfolipidet, illetve szövetspecifikus lipidkeveréket oldottunk n-dodekánban (2-10 w/V %). Erre adagoltuk a donoroldali szűrletet (150 μl). A mérőtálcákat összeillesztettük, a párolgás elkerülése végett lefedtük, és 4 órán át 37 °C-on inkubáltuk. Az inkubálási idő lejárta után a donor- és akceptoroldalon kialakult oldatkoncentrációkat HPLC-DAD módszerrel határoztuk meg. A kapott értékekből számítottuk ki az effektív permeabilitást (Pe, cm/s*10-6), mely a hatóanyag membránon keresztüli átjutását jellemzi, illetve a membránretenciót (MR%), mely a membránban feldúsult anyaghányadot adja meg.
A technika főbb változtatható paraméterei a donor- és akceptoroldali pufferek térfogata és pH-ja, a membrán lipidösszetétele és oldószere, az inkubálási idő és hőmérséklet. Munkám során ezeket a paramétereket optimáltuk a kívánt fiziológiás folyamat pontosabb modelljének kialakításához, illetve az in vivo farmakokinetikai adatok pontosabb megközelítéséhez.
Eddigi eredmények
(1) A Richter Gedeon Nyrt. eredeti kutatása elsősorban a központi idegrendszeri hatású anyagokra fókuszál, ezért elsőként a vegyületek vér-agy gáton keresztüli átjutását előrejelző PAMPA-BBB modellt optimáltuk [M1]. A PAMPA technika egyik előnye a flexibilitása: a modellezni kívánt fiziológiás körülményekhez igazodva változtathatjuk a mérési körülményeket. Az optimálási lépések során a mért permeabilitási értékeket a vegyületek in vivo logBB (agy/plazma arány) értékeihez viszonyítottuk, s figyeltük a paraméterek változtatásának korrelációra gyakorolt hatását. A jellemzően hosszú, akár 18 órás inkubálási időt lerövidítettük 4 órára, a hőmérsékletet a testhőmérsékletnek megfelelő 37 °C-ra emeltük. Beállítottuk a membrán optimális lipidösszetételét (különböző koncentrációkban oldottunk sertés agyi lipidextraktumot n-dodekánban, vagy n-dodekán és n-hexán elegyében). A donor- és akceptoroldalon kialakult anyagkoncentrációkat HPLC-vel határoztuk meg. Ezek segítségével egy olyan modellt kaptunk, mely alkalmas nagy pontossággal előre jelezni a vegyületek vér-agy gáton keresztüli átjutását (3.ábra).

3. ábra. A vér-agy gáton keresztüli átjutás előrejelzése
(2) A foszfolipidózis (PLD) egy gyógyszerek által kiváltott lipid-anyagcsere megváltozásával járó rendellenesség [5]. A hatóanyagok a sejtek membránján átjutva a 7,4-es pH-jú citoszolba kerülnek, s onnan bejuthatnak a 4-es pH-jú lizoszómába [6]. Itt egyes hatóanyagok a közeg kémhatása révén ionos formába kerülnek, ezért nem tudnak a lizoszómából kijutni, ott felhalmozódnak, ezáltal mellékhatásokat okoznak. A PAMPA modellel ezeket a körülményeket képeztük le: a donoroldalon 7,4-es, az akceptoroldalon 4-es pH-jú közeget alkalmaztunk. Membránként különböző szöveti foszfolipidkeverékeket oldottunk n-dodekánban. Azt tapasztaltuk, hogy a szervezetben foszfolipidózist okozó (PLD+) vegyületek permeabilitására magas értéket kaptunk (Pe >25*10-6 cm/s), a foszfolipidózist nem okozók (PLD-) esetében alacsony értéket. Így az eddig leírt számításos kémiai és in vitro sejtes modelleknél pontosabb módszert kaptunk a foszfolipidózis kialakulásának becslésére [M2].
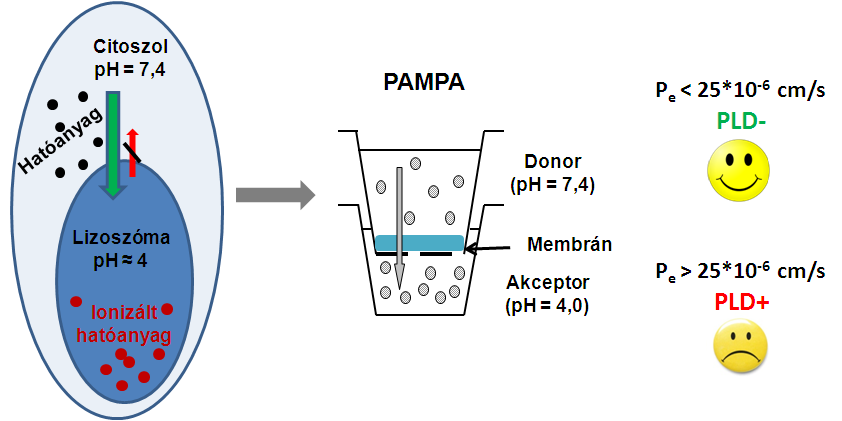
4. ábra. A foszfolipidózis kialakulásának mechanizmusa és előrejelzése PAMPA modellel
(3) Munkánk során a PAMPA-BBB módszert validáltuk keverék minták, összetett növényi kivonatok vizsgálatára [M4]. Megállapítottuk, hogy a modell előrejelző képessége megőrzi pontosságát a természetes anyagokra nézve, s nagy „fitokémiai szelektivitása” miatt egyedi lehetőséget jelent vér-agy gáton átjutó komponensek azonosítására növényi kivonatokból, így akár új, eddig ismeretlen anyagok is kimutathatóak, izolálhatóak.
Ezzel a technikával szűrtük a Richter 1760 db növényi kivonatból álló gyűjteményét (5. ábra).
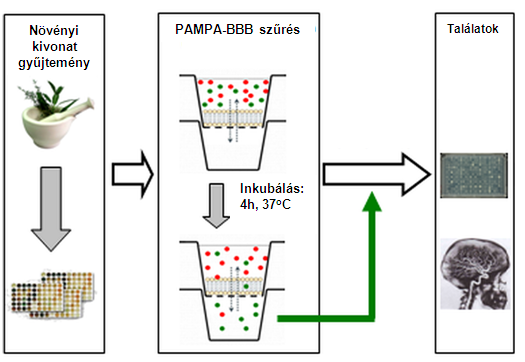
5. ábra. Növényi kivonat gyűjtemény szűrése a PAMPA-BBB modellel
Várható impakt, további kutatás
A PAMPA-BBB modellt a publikáció megjelenése óta a Richterben az új vegyületek fizikai-kémiai jellemzésére kiterjedten alkalmazzuk. A foszfolipidózis előrejelzésére kidolgozott modell az eddig publikált in vitro nem-sejtes módszerek közül a legpontosabb, robusztus és költséghatékony. A keverék mintákra, természetes anyagokra validált PAMPA-BBB modell más, nemzetközileg elismert kutatócsoportok előtt is megnyitotta az utat a növényi kivonatok hatékonyabb vizsgálatára [7].
Eddigi eredményeinket a nemzetközi szakmai közvélemény érdeklődéssel fogadta, publikációinkra többen hivatkoztak saját munkájukban.
A jövőben szeretnénk a máj- és a tüdőszövetre jellemző hatóanyag-megoszlási folyamatokat modellezni a PAMPA módszerrel.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája
[M1] Müller, J.; Esső, K.; Dargó, G.; Könczöl, Á.; Balogh, Gy. T. Tuning the predictive capacity of the PAMPA-BBB model. European Journal of Pharmaceutical Sciences, 2015. 79, 53–60.
[M2] Balogh, Gy. T.; Müller, J.; Könczöl, Á. pH-gradient PAMPA-based in vitro model assay for drug-induced phospholipidosis in early stage of drug discovery. European Journal of Pharmaceutical Sciences, 2013. 49 (1), 81–89.
[M3] Könczöl, Á.; Müller, J.; Földes, E.; Béni, Z.; Végh, K.; Kéry, Á.; Balogh, Gy. T. Applicability of a blood-brain barrier specific artificial membrane permeability assay at the early stage of natural product-based CNS drug discovery. Journal of Natural Products, 2013. 76, 655–663.
[M4] Borbás, E.; Balogh, A.; Bocz, K.; Müller, J.; Kiserdei, É.; Vígh, T.; Sinkó, B.; Marosi, A.; Halász, A.; Dohányos, Z.; Szente, L.; Balogh, Gy. T.; Nagy, Zs. K. In vitro dissolution-permeation evaluation of an electrospun cyclodextrin-based formulation of aripiprazole using μFlux™. Internatioanl Journal of Pharmaceutics, 2015. 491 (1-2) 180-189.
[M5] Szabó, T.; Hirsch, E.; Tóth, T.; Müller, J.; Riethmüller, E.; Balogh, Gy. T.; Huszthy, P. Synthesis and enantioselective transport studies of optically active lipophilic proton-ionizable crown ethers containing a diarylphosphinic acid unit. Tetrahedron: Asymmetry. 2015. 26 (12–13) 650–656.
[M6] Müller, J.; Martins, A.; Csábi, J.; Fenyvesi, F.; Könczöl, Á.; Hunyadi, A.; Balogh, Gy. T. Ecdysteroids as Chemo-sensitizers Against CNS Tumors: in vitro BBB Penetration and Strong Sensitizing Activity to Vincristine. European Journal of Pharmaceutics and Biopharmaceutics . Beküldve.
Linkgyűjtemény
Hivatkozások listája
[1] Keserű, Gy. M. (szerk). A gyógyszerkutatás kémiája. Akadémiai Kiadó. 2011.
[2] Avdeef, A. Absorption and Drug Development Solubility, Permeability and Charge State. pION, Inc. John Wiley & Sons 2003.
[3] Kansy, M.; Senner, F.; Gubernator, K, Journal of Medicinal Chemistry, 1998., 41, 1007–1010.
[4] Di, L.; Kerns, E. H.; Fan, K.; McConnell, O. J.; Carter, G. T. European Journal of Medicinal Chemistry, 2003., 38 (3), 223–232.
[5] Anderson, N.; Borlak, J., FEBS Letters, 2006., 580, 5533–5540.
[6] Hein,L.; Lullmann-Rauch, R.; Mohr, K., Xenobiotica 1990. 20, 1259–1267.
[7] Petit, C.; Bujard, A.; Skalicka-Wozniak, K., Wolfender, J-L. Planta Medica, 2016., 82 (5).
