|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME VBK / Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Tóth Tünde
Koronaéter-alapú akridon egységet tartalmazó szenzor- és akridin egységet tartalmazó szelektormolekulák előállítása és vizsgálata
A kutatási téma néhány soros bemutatása
A háztartási és ipari eredetű szennyvizek jelentős mennyiségű toxikus anyagot, nehézfémet tartalmazhatnak, ezért e vegyületek szelektív kimutatására alkalmas szenzormolekulák és szelektív megkötésére alkalmas szelektormolekulák kifejlesztése nagy jelentőséggel bír. Kutatómunkám során akridonegységet tartalmazó 18-korona-6-éter alapú szenzormolekulák szintézisét valósítottam meg, melyek komplexképző tulajdonságát UV–látható és egykristály röntgendiffrakciós módszerekkel vizsgáltuk.
A kutatóhely rövid bemutatása
A BME Szerves Kémia és Technológia Tanszékén a Szupramolekuláris Kémia Kutatócsoportban Dr. Huszthy Péter vezetésével koronaéter-alapú, kationok komplexálására alkalmas szenzormolekulákkal, valamint primer aminok elválasztására alkalmas szelektormolekulákkal kapcsolatos kutatásokat végzünk. Az előállított vegyületek komplexképző tulajdonságát a Richter Gedeon Nyrt-vel, az MTA TTK Enzimológiai Intézettel és a BME Alkalmazott Biotechnológia és Élelmiszertudományi Tanszékkel együttműködve vizsgáljuk.
A kutatás történetének, tágabb kontextusának bemutatása
A szupramolekuláris kémia a nem kovalens kötőerőkkel összetartott molekulatársulások keletkezésével, tulajdonságaival, valamint felhasználási lehetőségeivel foglalkozik [1]. Ezen molekulatársulások létrejötte a molekuláris felismerés jelenségén alapul, mely során egy gazdamolekula az őt körülvevő vendégmolekulák halmazából szelektíven kiválaszt egy adott molekulát, majd vele másodlagos kötőerőkkel (pl.hidrogén-híd) összetartott, rendezett szerkezetet, komplexet alkot. Ennek az élő természetben általánosan előforduló jelenségnek szemléletes példája a természetes ionhordozók (pl. K+ szelektív Valinomicin) szelektív fémionmegkötő képessége és transzportja a biológiai membránokon keresztül (1. ábra A,B).
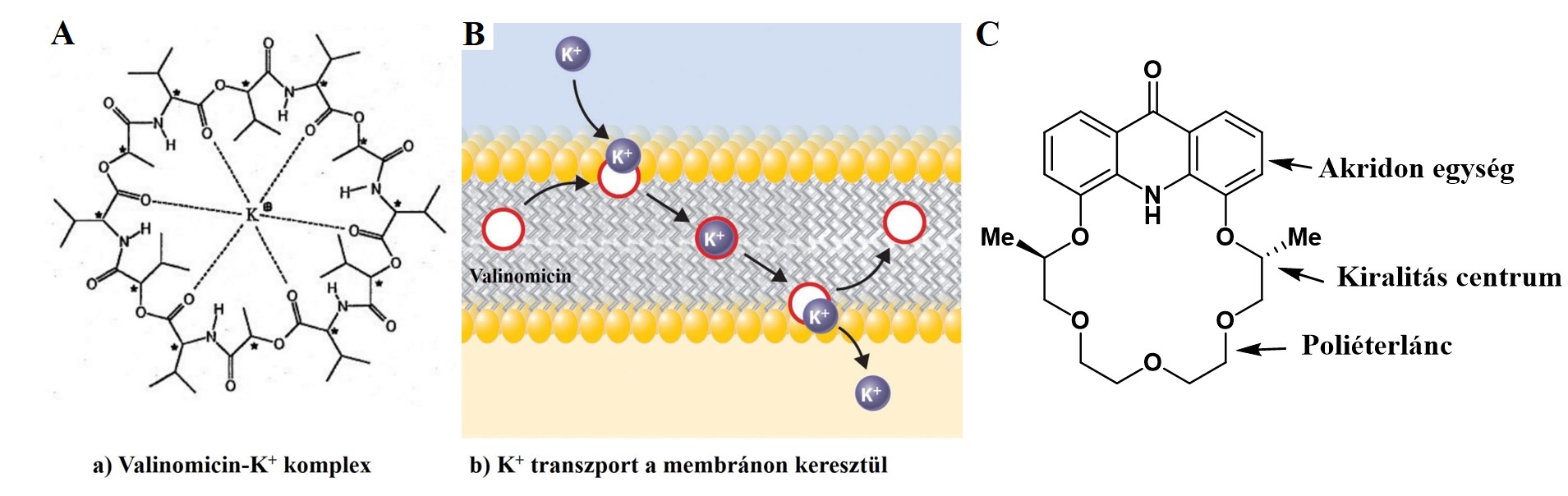
1. ábra
A Nobel-díjas Charles Pedersen munkássága rávilágított arra [2], hogy a molekuláris felismerés jelensége nem csupán az élő szervezetek sajátsága, hanem szintetikus makromolekulákkal – az általa elsőként szintetizált és vizsgált koronaéterekkel – is kiváltható. Pedersen felismerte, hogy a koronaéterek üregméretüktől függően eltérő stabilitású komplexeket képeznek kémiailag hasonló fémionokkal. A koronaéterek komplexképző tulajdonsága a poliéter makrogyűrű méretének, valamint a heteroatomok minőségének változtatásával finomhangolható. Triciklusos heteroaromás egység (pl. akridon gyűrű) makrociklusba történő beépítésével a konformáció merevsége növelhető (1. ábra C), amely szintén a szelektivitás növekedését eredményezi. Továbbá az aromás gyűrűrendszer a komplex stabilitását növelő, π–π és kation–π kölcsönhatások kialakítására is képes. Emellett az akridon egységet tartalmazó koronaéterek komplexképző tulajdonsága, fluoro- és kromogén sajátságuk révén UV–látható és fluoreszcencia spektroszkópiával is vizsgálható.
A kutatás célja, a megválaszolandó kérdések.
Az ionszenzorok fejlesztése széleskörű alkalmazhatóságuk (gyógyszer- és növényvédőszer és illatszeripar) miatt nagy jelentőségű, segítségükkel például fémionokkal szennyezett vizekben a fémionok kimutathatók, mennyiségük mérhető [3]. Ezért kutatómunkám egy részében akridon egységet tartalmazó 18-korona-6-éter típusú szenzormolekulák szintézisét tűztük ki célul, melyek komplexképző tulajdonságát UV–látható spektroszkópiás módszerrel vizsgáltam [4]. A fémionnal történő komplexképzés mechanizmusát részletesebben is tanulmányozni kívántuk egykristály röntgendiffrakcióval (XRD) [5].
Az optikailag aktív vegyületek enantiomerjei jelentősen eltérő farmakológiai hatással rendelkezhetnek, ezért lényeges ezen élettani szempontból fontos szerves vegyületek enantiomer arányának pontos meghatározása. Az erre alkalmas módszerek közül az egyik leggyakrabban használt a királis állófázisokon (CSP) végzett nagy hatékonyságú folyadékkromatográfia (HPLC). Ezért csoportunkban számos akridin és piridin egységet tartalmazó 18-korona-6-éter szelektormolekula-alapú állófázis előállítását kívántuk megvalósítani, amelyek enantiomerelválasztó képességét HPLC módszerrel a Richter Gedeon Nyrt-ben vizsgáltuk [6-9]. Az enantiomer megkülönböztetőképesség-hátterét is szerettük volna feltérképezni, ezért előállítottuk egy akridino-18-korona-6-éter és a biológiai szempontból is jelentős 1-(1-naftil)-etilamin mindkét enantiomerével képzett diasztereomer komplexeit egykristály-röntgendiffrakciós mérés céljából [10].
Módszerek
A vegyületek szintézise során preparatív szerves kémiai módszereket alkalmaztunk. A reakciók lefutását és végbemenetelét vékonyréteg-kromatográfiás módszerrel követtük. Az anyagok tisztítására oszlopkromatográfiát, átkristályosítást, illetve eldörzsölést alkalmaztunk. Az anyagok tisztaságának ellenőrzésére vékonyréteg-kromatográfiát, olvadáspontmérést, illetve optikai forgatóképesség-mérést használtunk. Az előállított vegyületek szerkezetét spektroszkópiai módszerekkel (IR,
1H- és 13C-NMR,
LC-MS), valamint elemanalízissel igazoltuk. Az előállított szenzorvegyületek fémionokkal szemben mutatott komplexképzési tulajdonságait UV–látható spektroszkópiával tanulmányoztuk, acetonitril oldószerben. Az UV–látható spektroszkópia azon alapul, hogy a 10–780 nm hullámhosszúságú fényt bizonyos funkciós csoportokkal rendelkező vegyületek elnyelik, abszorbeálják, így rájuk jellemző abszorbancia–hullámhossz spektrumok rögzíthetők. Amennyiben a vizsgált vegyület komplexet képez valamelyik fémionnal, a komplex abszorbancia spektruma eltér, esetleg valamelyik irányba el is tolódik az alap abszorbanciaspektrumhoz képest. A komplexképzés erősségét jellemző stabilitási (egyensúlyi) állandót numerikus módszerekkel, illetve a globális nemlineáris regressziós módszert alkalmazó ReactLab Equilibria™ programmal határoztuk meg.
A szelektormolekulák enantiomer megkülönböztetőképességét nagy hatékonyságú folyadékkromatográfiával vizsgáltuk. Ehhez először a szelektormolekulát kovalens kötésekkel szilikagél hordozóhoz rögzítettük, az így módosított szilikagélből szuszpenziót (szilárd anyag és oldószer keveréke) készítettünk, majd 500 bar nyomás mellett egy üres HPLC-oszlopba töltöttük (ez az ún. zagytöltés módszere). A rögzítés lehetővé teszi a szelektor újrafelhasználhatóságát, és biztosítja a makrociklus szelektivitását a komplexképzésben.
Egy HPLC-oszlopot alternatív úton is előállítottunk a folyamatos áramlásos kémia alkalmazásával; ekkor a szilikagélhez való rögzítésre alkalmas vegyület oldatát, magas hőmérsékleten és nagy nyomáson, folyamatos áramban áramoltattuk a szelektort nem tartalmazó szilikagéllel töltött HPLC-oszlopon keresztül, így kiépült a kovalens kötés a szilárd hordozó és a koronaéter között. A kész oszlopokat HPLC készülékkel vizsgáltuk poláris oldószerek alkalmazásával (ez a fordított fázisú módszer). A komponensek elkülönülésének alapja, hogy azok vándorlási sebessége megfelelő körülmények esetén eltérő, ezért az elválasztás során alkalmazott oszlopról eltérő időben távoznak. A királis kromatográfiában a szelektormolekula az elválasztandó királis vegyületek enantiomerjeivel eltérő stabilitású komplexeket képez, így azok elkülönítése lehetővé válik.
Az ionszelektivitás és az enantiomerszelektivitás mechanizmusának feltérképezése céljából a vizsgált koronaéterekből és a komplexált vendégmolekulákból, különböző oldószerek felhasználásával, néhány tizedmilliméter kiterjedésű kristályt képeztünk, amelyeket egykristály-röntgendiffrakciós módszerrel vizsgáltunk (XRD). A módszer azon alapszik, hogy a röntgensugarak a kristályokon áthaladva diffrakciót szenvednek, mivel a hullámhosszuk (10-10–10-13 m) összemérhető a kristályban lévő rácssíkok közötti távolsággal. Különböző összefüggések felhasználásával az ismeretlen szerkezetű egykristály atomjainak térbeli elrendeződése meghatározható. Ebből pedig következtetni lehet a szelektív komplexképzés alapjául szolgáló másodlagos kölcsönhatásokra is.
Eddigi eredmények
Doktori munkám egy részében akridonegységet tartalmazó 18-korona-6-éter típusú szenzormolekulák szintézisével foglalkoztam. Az 1 és 2 potenciális kationszenzorok (2. ábra A) szintézise során kilenc új intermediert állítottam elő [4]. A szenzorok kilenc fémion perklorátsóval szemben mutatott ionszelektivitását UV–látható spektroszkópiával tanulmányoztam, az 1 vegyület ólomionra bizonyult szelektívnek (2. ábra B). Az ólomionnal való komplexképzés mechanizmusának feltárása érdekében az 1 szenzormolekula ólomiont tartalmazó acetonitriles oldatából sikerült röntgenkrisztallográfiai vizsgálatokra alkalmas egykristályt növesztenem [5]. Az XRD-vizsgálatokat az MTA TTK Enzimológiai Intézettel és a BME Alkalmazott Biotechnológia és Élelmiszertudományi Tanszékkel együttműködve végeztük. A vizsgálatok azt mutatták, hogy a koronaéter két, egymással dinamikus egyensúlyban lévő, (tautomer) formában van jelen. Az egyik vegyület akridon formában maradt és egy vízmolekulát komplexál, a másik pedig hidroxi-akridin formává rendeződött át és ólomiont komplexál (2. ábra C, a kristályban két perklorát ellenion is jelen van).
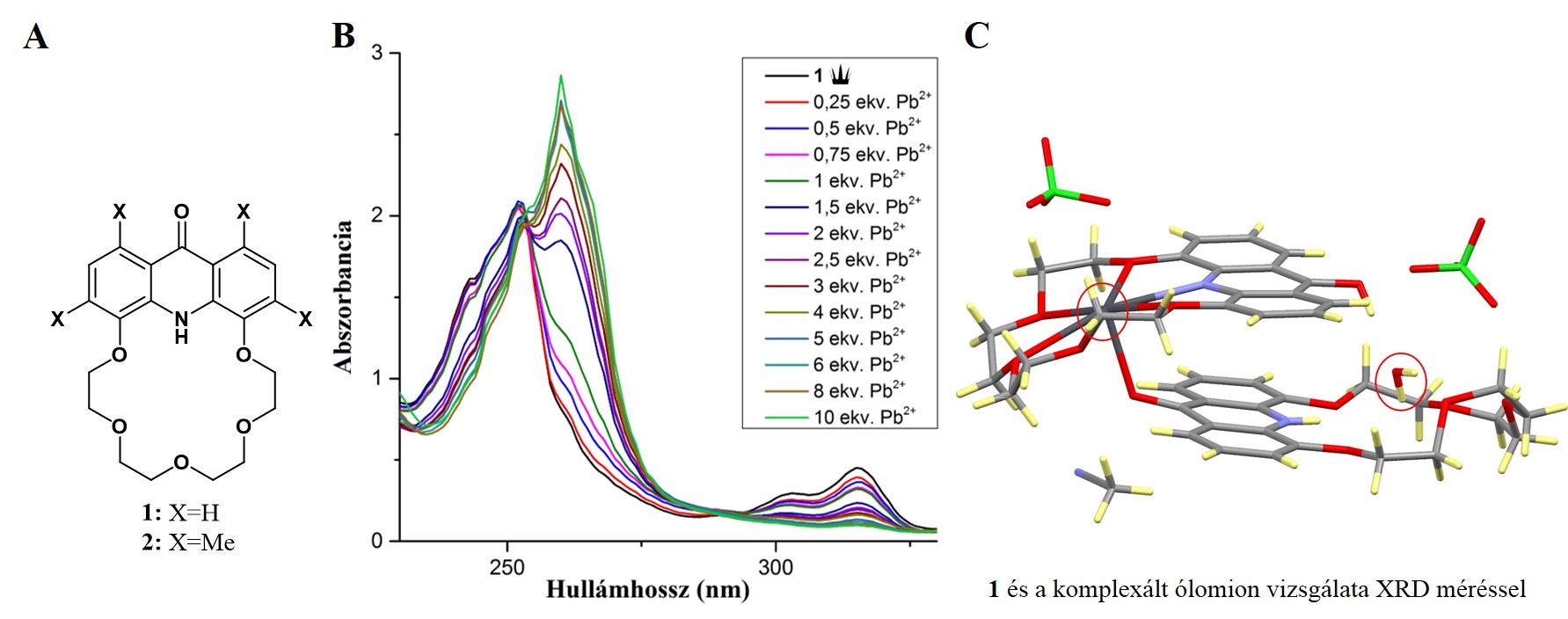
2. ábra
Munkám második felében királis állófázisok előállításával foglalkoztam. Részt vettem egy piridino-18-korona-6-éter alapú állófázis vizsgálatában [6]. Sikeresen szintetizáltam öt akridinegységet tartalmazó szelektormolekulát, az (R,R)-3 és (R,R)-4 vegyületekből királis állófázisokat alakítottam ki (3. ábra A, B) [7–9].
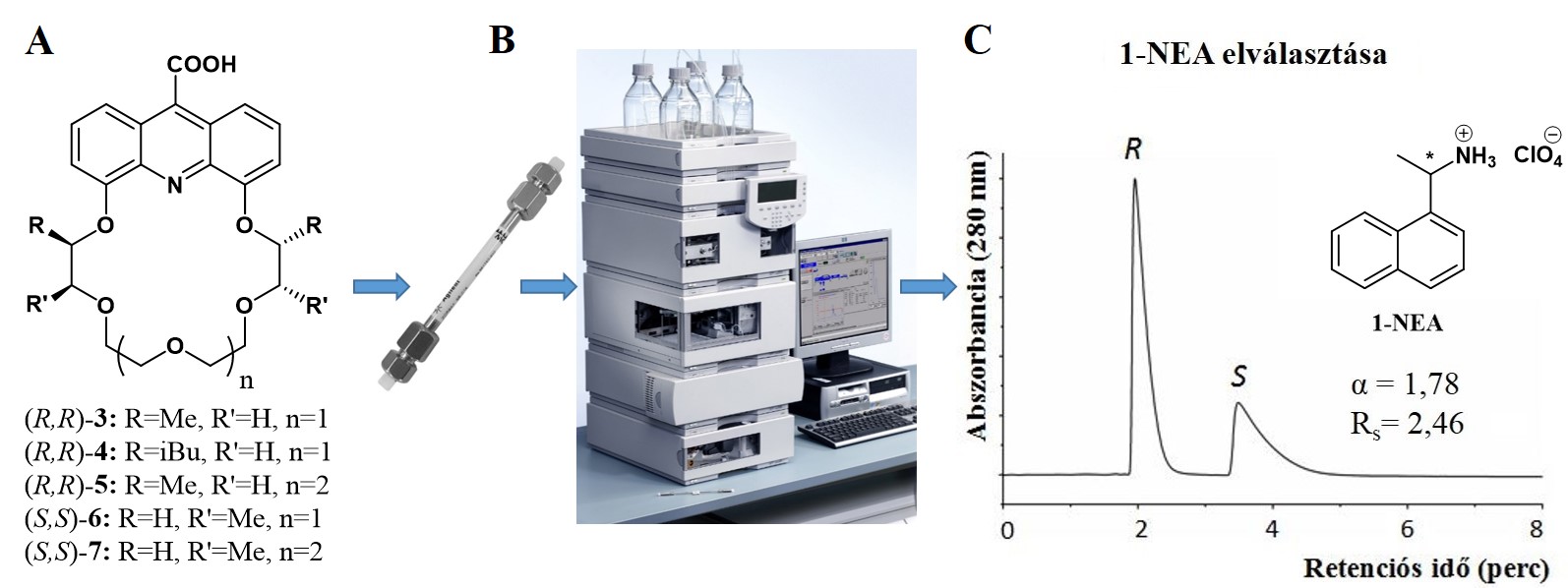
3. ábra
A vegyületek protonált primer aminokkal szemben mutatott enantiomermegkülönböztető-képességét a Richter Gedeon Nyrt-ben vizsgáltuk. Elsősorban biológiai jelentőségű aminok sóit választottuk el; példaként emelném ki az 1-(1-naftil)etilamint [1-NEA,
3. ábra C], amelyet az iparban heterogén fázisú (vagyis két vagy több, egymással eltérő fázisban lévő anyag pl. szilárd-folyadék) reakciókban szokták alkalmazni a reakció gyorsítására katalizátorként. Emellett egyes származékai szívritmus-szabályzó és helyi érzéstelenítő hatással rendelkeznek, így nagy fontosságú a kiinduló anyag megfelelő minősége. Valamennyi vizsgált vegyület esetében nagy szelektivitást és alapvonal-elválást tapasztaltunk (3. ábra C). Kidolgoztunk egy új módszert királis állófázisok előállítására, az (R,R)-3 vegyületet a folyamatos áramlásos kémia segítségével is szilárd hordozóhoz rögzítettük [8].
Sikeresen előállítottam az [(R,R)-3-mal analóg] (R,R)-8 az 1-NEA mindkét enantiomerével képzett diasztereomer sóját röntgendiffrakciós mérés céljából (4. ábra), így vizsgálni tudtuk a HPLC oszlopon történő enantiomermegkülönböztetés mechanizmusát. A HPLC mérésekhez hasonlóan itt is heterokirális preferenciát tapasztaltunk, vagyis az (R,R)-8 az (S)-1-NEA-val képzett stabilabb komplexet (4. ábra) [10].
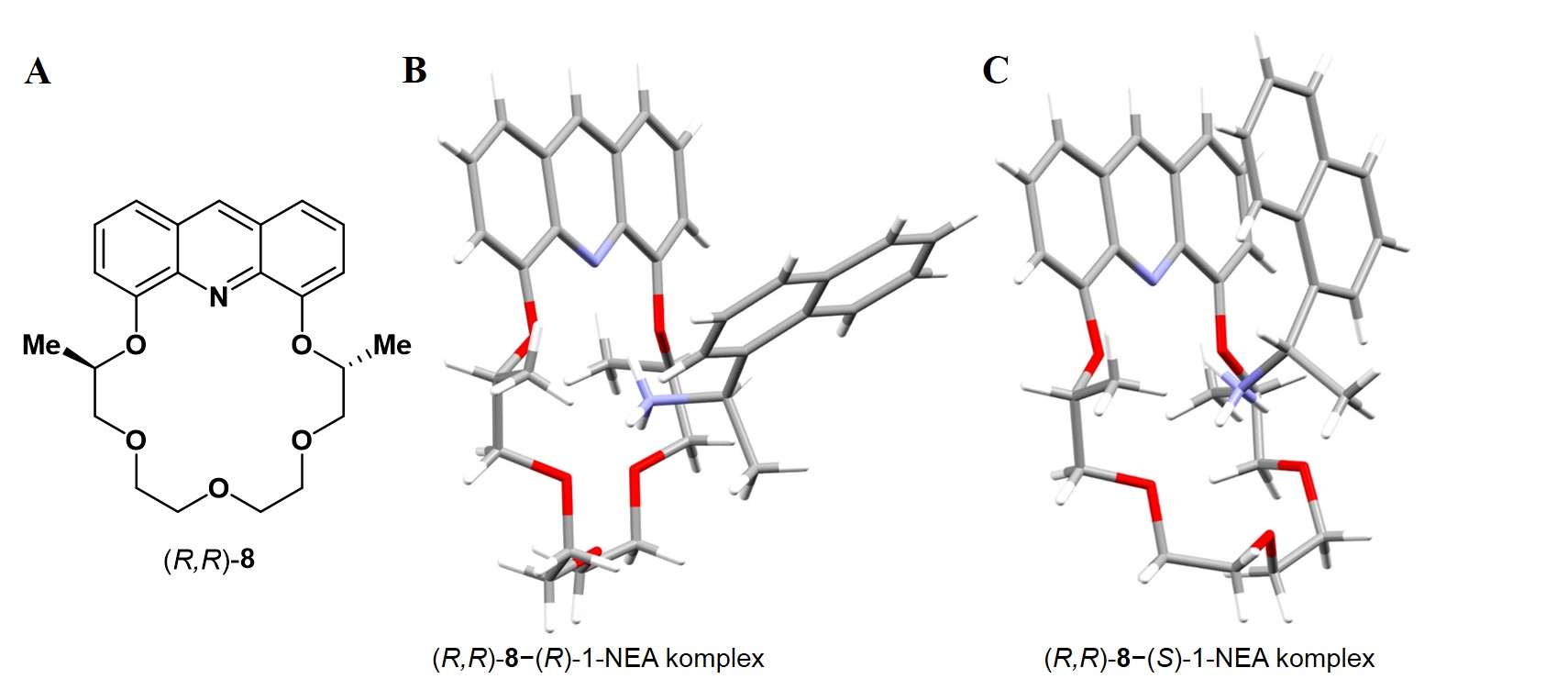
4. ábra
Várható impakt, további kutatás
Doktori munkám során koronaéter típusú, akridonegységet tartalmazó szenzormolekulákat és akridinegységet tartalmazó szelektormolekulákat állítottam elő. Eredményeinket öt nemzetközi folyóiratban megjelent közleményben foglaltuk össze, további két közlemény bírálata folyamatban van. A kutatások nemzetközi (CRP/HUN14-01 ICGEB Research Grant) és hazai (OTKA K112289, K109486, TÁMOP-4.2.1/B-09/1/KMR-2010-0002) pályázatok részét képezik.
Célul tűztük ki az 1 szenzor lipofil (hidrofób) oldalláncokkal ellátott származékainak előállítását, mely vegyületekből ionszelektív elektródot tervezünk készíteni, így ezek segítségével ólommal szennyezett vízben az ólomionok kimutatása mellett, a koncentráció mérése is megoldható lenne. További céljaink között szerepel az (R,R)-5, (S,S)-6 és (S,S)-7 vegyületekből királis állófázisok kialakítása az áramlásos kémia alkalmazásával.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája.
[A] Németh T, Kormos A, Tóth T, Balogh Gy T, Huszthy P
Monatshefte für Chemie 2015, 146: (8) pp. 1291–1297.
[B] Németh T, Golcs Á, Leveles I, Tóth T, Vértessy B G, Huszthy P
Structural Chemistry 2015, 26: (5) pp. 1467–1471.
[C] Lévai S, Németh T, Fődi T, Kupai J, Tóth T, Huszthy P, Balogh Gy T
Journal of Pharmaceutical and Biomedical Analysis 2015, 115: pp. 192–195.
[D] Németh T, Lévai S, Kormos A, Kupai J, Tóth T, Balogh Gy T, Huszthy P
Chirality 2014, 26:(10) pp. 651–654.
[E] Németh T, Lévai S, Fődi T, Kupai J, Túrós Gy, Tóth T, Huszthy P, Balogh Gy T
Journal of Chromatographic Science 2015, 53:(3) pp. 431–435.
[F] Németh T, Dargó G, Petró J L, Krámos B, Béni Z, Nagy J, Balogh Gy T, Huszthy P,
Tóth T előkészületben a Journal of Pharmaceutical and Biomedical Analysis
folyóirathoz történő benyújtásra
[G] Tóth T, Németh T, Leveles I, Vértessy B G, Huszthy P előkészületben a
Structural Chemistry folyóirathoz történő benyújtásra
Linkgyűjtemény
Hivatkozások listája
[1] Steed J W, Atwood J L, Supramolecular Chemistry
2009, Wiley, 2nd edition.
[2] Pedersen C J Journal of the American Chemical Society 1967, 89, 2495–2496.
[3] Chemosensors of Ion and Molecule Recognition; Desvergne J P, Czarnik A W, Eds.
NATO ASI Series C; Kluwer: Dordrecht, The Netherlands,
1997, Vol. 492.
[4] Németh T, Kormos A, Tóth T, Balogh Gy T, Huszthy P
Monatshefte für Chemie
2015, 146: (8) pp. 1291–1297.
[5] Németh T, Golcs Á, Leveles I, Tóth T, Vértessy B G, Huszthy P
Structural Chemistry 2015, 26: (5) pp. 1467–1471.
[6] Lévai S, Németh T, Fődi T, Kupai J, Tóth T, Huszthy P, Balogh Gy T
Journal of Pharmaceutical and Biomedical Analysis 2015, 115: pp. 192–195.
[7] Németh T, Lévai S, Kormos A, Kupai J, Tóth T, Balogh Gy T, Huszthy P
Chirality 2014, 26:(10) pp. 651–654.
[8] Németh T, Lévai S, Fődi T, Kupai J, Túrós Gy, Tóth T, Huszthy P, Balogh Gy T
Journal of Chromatographic Science 2015, 53:(3) pp. 431–435.
[9] Németh T, Dargó G, Petró J L, Krámos B, Béni Z, Nagy J, Balogh Gy T, Huszthy P,
Tóth T előkészületben a Journal of Pharmaceutical and Biomedical Analysis
folyóirathoz történő benyújtásra
[10] Tóth T, Németh T, Leveles I, Vértessy B G, Huszthy P előkészületben a
Structural Chemistry folyóirathoz történő benyújtásra
