|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME VBK / Szervetlen és Analitikai Kémia Tanszék
Témavezető: Dr. Gyurcsányi E. Róbert
Nanopórus számlálók fejlesztése és alkalmazása
A kutatási téma néhány soros bemutatása
Az elmúlt évek világméretű vírusjárványai miatt továbbra is kiemelt kutatási terület a különböző vírusdiagnosztikai-analitikai eljárások fejlesztése. A fertőzések megbízható azonosításához gyors, pontos, költséghatékony és könnyen alkalmazható eljárásra van szükség. Erre a komplex problémára jelenthet megoldást a kutatócsoportunk által fejlesztett nanopórusos részecskeszámláló szenzor, mellyel szintetikus és biológiai eredetű nanorészecskék karakterizálása valósítható meg.
A kutatóhely rövid bemutatása
Bár a Kémiai Nanoérzékelők Kutatócsoport csak 3 éve jött létre, a csoport elődje hazai és nemzetközi együttműködések keretében már korábban is különböző biológiai markerek és kémiai komponensek kimutatására alkalmas nanotechnológiai eszközök fejlesztésével foglalkozott. Más érdekes kihívások mellett, nanopórusos érzékelőkkel különböző eredetű, klinikailag releváns nanorészecskéket vizsgálunk és analizálunk.
A kutatás történetének, tágabb kontextusának bemutatása
Járvány sújtotta területeken a fertőzések gyors azonosítása és elkülönítése kulcsfontosságú, ezért a tévesen negatív eredményű vizsgálatok végzetes következményekkel járnak. A legelterjedtebb virológiai módszerekben vagy sejtkultúrákban tenyésztik ki a vírust, vagy valamilyen nukleinsav-amplifikációs eljárás alkalmazásával a vírus genetikai állományát detektálják. Ezek egyike sem kimondottan alkalmas helyszíni gyors tesztek kivitelezésére. [1]
A Bill&Melinda Gates alapítvány célja a poliovírus visszaszorítása világszerte, a rászoruló gyermekek vakcinálásával. A polio azonosítása tünetei alapján nem egyértelmű, csak a megbetegedések kis hányadánál szövődményként fellépő bénulás esetén válik egyértelművé a vírusfertőzés jelenléte. Ezt a problémát hidalhatják át az intakt vírus direkt kimutatására alkalmas, szelektív felismerő ágenst tartalmazó bioszenzorok. Kutatómunkám ehhez a projekthez kapcsolódott.
Olyan költséghatékony vírusmeghatározási módszerek kidolgozására törekszünk, amely a vírus nanorészecske-karakterének felhasználásán alapul. A fejlesztett szenzor a Coulter-elven [2] működik, de a sejtszámlálókban alkalmazott mikrométeres pórusok helyett a vírusok méretével összemérhető pórusokat alkalmaz. [3] A módszer lényege, hogy két, egymástól egyetlen pórussal elválasztott oldatcellába elektródok merülnek; az elektródokra feszültséget kapcsolva a detektálható áram nagyságát a cellákba töltött elektrolitok vezetőképessége és a pórus geometriája határozza meg. [4]
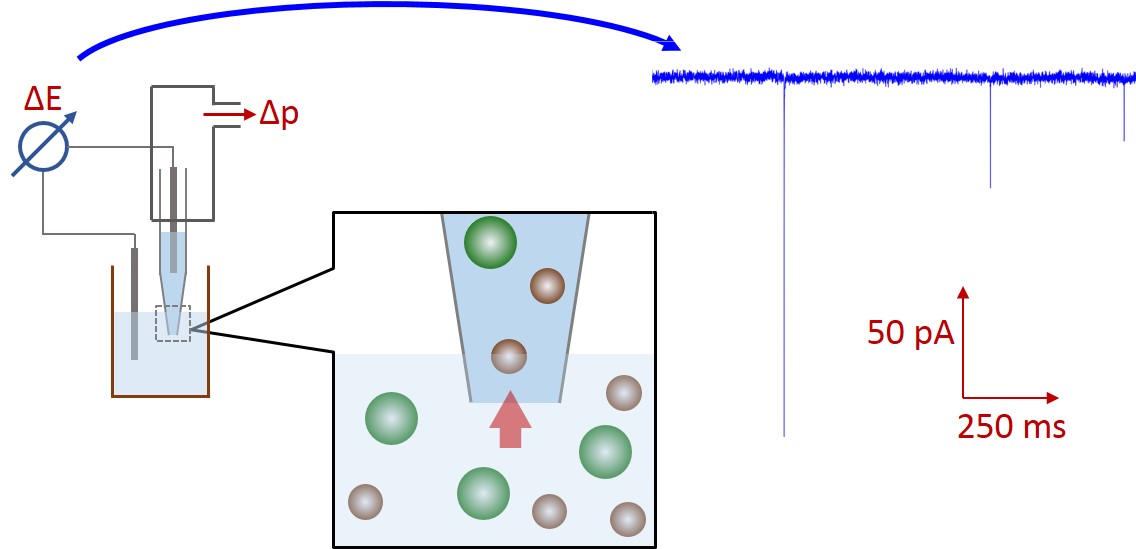
1. ábra: Az ellenálláspulzus-technika működési elve.
A póruson keresztül haladó részecskék a méretükkel arányos elektrolit-térfogatot szorítanak ki a pórusból, így az érzékelő zónában az ellenállás megnő, a mért áram lecsökken. Az áramcsökkenések amplitúdói a részecskék méretétől, időtartamai a részecskék sebességétől, száma a részecskekoncentrációtól függ. Az ellenálláspulzus-technikával (RPS) minden részecske egyedileg detektálható, ezért sztochasztikus információt szolgáltat az elemzett mintáról. Egy pórus a méretéhez képest legfeljebb 60% átmérőjű nanorészecskék detektálására alkalmas. [5] Nagyobb részecskék eltömíthetik, míg az átmérő 20 %-ánál kisebbek áthaladása csak rossz jel/zaj viszonnyal, vagy egyáltalán nem detektálható.
A kutatás célja, a megválaszolandó kérdések.
A Coulter-számláló elv alkalmazásához a részecskemérethez megfelelő méretű érzékelő zónára, nanopórusra van szükség. Ezért olyan nanofabrikációs eljárásra volt szükségünk, mellyel elérhetjük a poliovírus mérettartományát, ami az irodalmi források szerint 24–30 nanométer. A vírus fehérjeburka ikozaéder alakú, ezért gyakorlatilag gömb alakú objektumnak tekinthető. [6]
Mivel ezen a területen nem volt korábbi tapasztalatunk, a módszert először nagyobb méretű latex nanorészecskékre optimáltam, majd a pórusátmérőt csökkentve egyre kisebb részecskék detektálását valósítottam meg. A részecskék áthaladásakor mért áramcsökkenések amplitúdói méretüktől, a jeleik gyakorisága koncentrációjuktól függ.
A gyakorlati alkalmazásoknál általában méret- és koncentrációstandardok segítségével, kalibrációs eljárással történik az analitikai információgyűjtés. [7] Valós mintáknál azonban a kalibráció esetenként nehezen kivitelezhető, ezért modell részecskeoldatokon vizsgáltuk, hogy megvalósítható-e kalibráció-nélküli módszerrel a méret- és koncentrációmeghatározás.
Fontos szegmense az analitikának, hogy valós biológiai mintákban szükség lehet a vírus és a mintamátrix (jellemzően szérum, vagy valamilyen környezeti minta) elválasztására. Megvizsgáltam, hogy milyen hatással vannak különböző minta-előkészítési eljárások a modelloldatok részecskeméret-eloszlására és koncentrációjára.
A kedvező eredmények után az eljárást kiterjesztettük oltóanyagból vagy sejttenyészetből származó, nem fertőző vírusok vizsgálatára.
Módszerek
Nanopórusok előállítására Sutter P-2000 kapillárishúzó készüléket használtam. A műszer jól kontrollált körülmények között felmelegíti és lágyítja az ismert geometriájú kvarckapillárist, majd programozott erővel széthúzza, és az elszakadó templátból két azonos geometriájú, kónuszos nanopipettát készít. A módszer előnye, hogy megfelelő programbeállításoknál a széthúzás erejének változtatásával jól szabályozható a kúpos pórus átmérője. Így a többi nanofabrikációs eljáráshoz képest gyorsan készíthetünk tetszőleges átmérőjű nanopórusokat.

2. ábra: A nanopipetta-húzás folyamata.
Megfelelő ionerősségű, felületaktív adalékot tartalmazó elektrolittal feltöltjük a nanopipettát. A kapillárist a méret-kompatibilis tartóba rögzítjük, ezáltal a betöltött oldatba Ag/AgCl elektród merül, és megoldható a gőztér nyomásszabályozása. Így az elemzési feladatnak megfelelően változtatható a nanorészecskék áthaladási sebessége, illetve a pórus eltömődése esetén egy nagy nyomáspulzussal kitisztítható a pórus.
Míg a hengeres pórusokon áthaladó részecskék által okozott maximális áramcsökkenések mértékét jól definiált modellekkel leírták, kúpos pórusoknál egyszerű analitikai megoldások nem állnak rendelkezésre. Általában a részecskeméret és pórusgeometria viszonyát különböző elhanyagolásokkal közelítik, vagy ismert átmérőjű részecskesztenderdekkel kalibrálják a pórus válaszjelét, és feltételezik, hogy a részecske térfogata arányos az okozott áramcsökkenéssel. [8]
Ahhoz, hogy a kalibrációs módszert helyettesíthessük, meg kellett határoznunk az összefüggést a nanopipetta geometriája és elektromos ellenállása között. Ehhez nagyszámú kapillárisból készítettem különböző átmérőjű nanopipettapárokat, majd minden esetben a pár egyik tagját pásztázó elektronmikroszkóppal vizsgáltam, másik felét elektrolittal töltöttem fel, és mértem az elektromos ellenállását. Így meghatároztunk egy R = f (dtip, α, ρ) függvényt, mellyel közvetlenül a nanopipetta elektromos ellenállásából kiszámítható a nanopipetta átmérője és félkúpszöge.
Kollégám szimulációkat futtatott, hogy meghatározza milyen hatással van a nanorészecske/nanopipetta átmérőaránya és a pórus félkúpszögének változása a részecske áthaladásakor létrejövő maximális ellenállás-növekedés, azaz áramcsökkenés mértékére. A modell meghatároz egy polinomiális felületet, melynek segítségével a nanopipetta ellenállásának ismeretében meghatározott pórusátmérő és félkúpszög felhasználásával a számlálási kísérletben mért maximális áramcsökkenések átszámolhatók a jelet okozó, gömb alakú részecske átmérőjévé. [TP1]
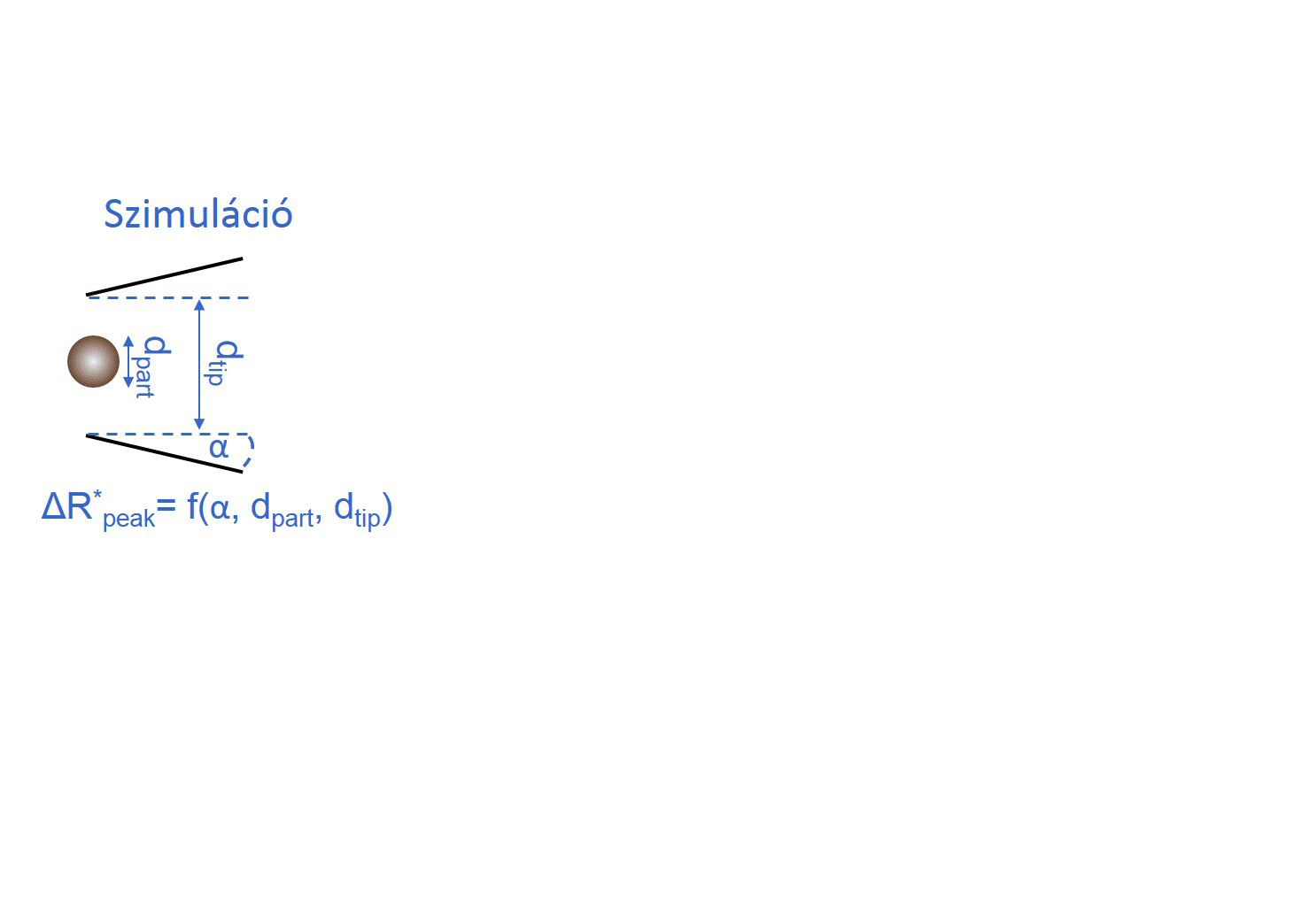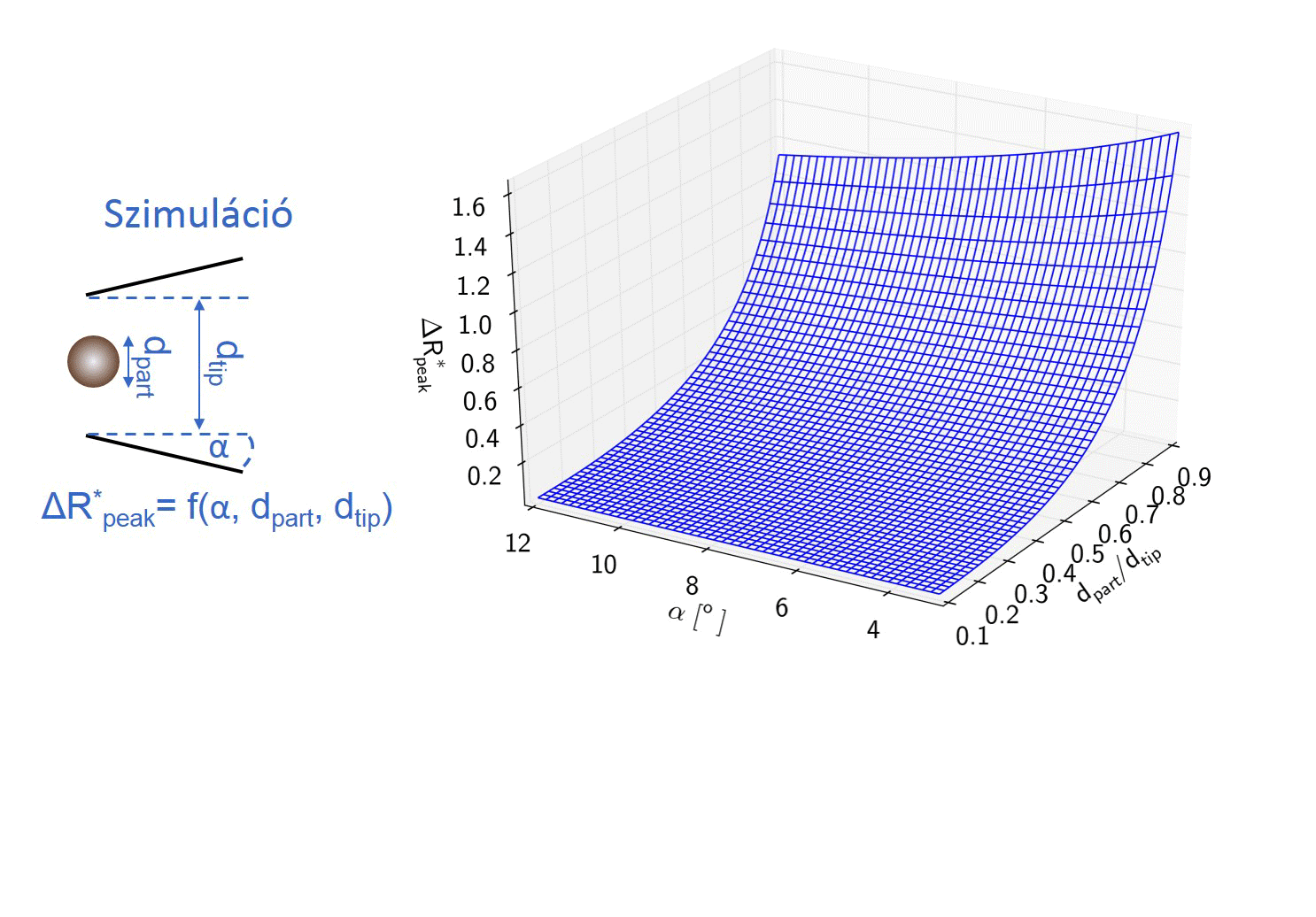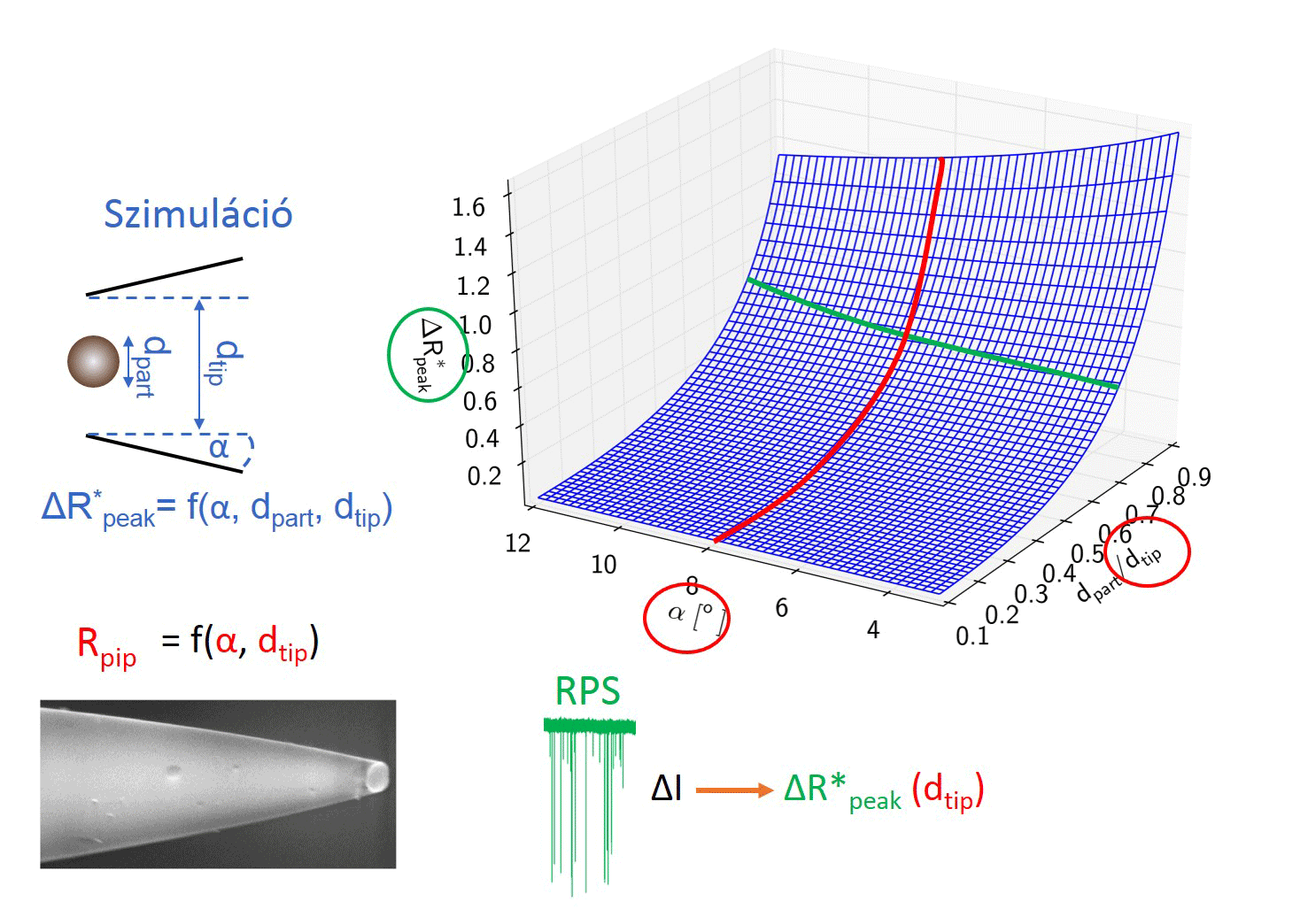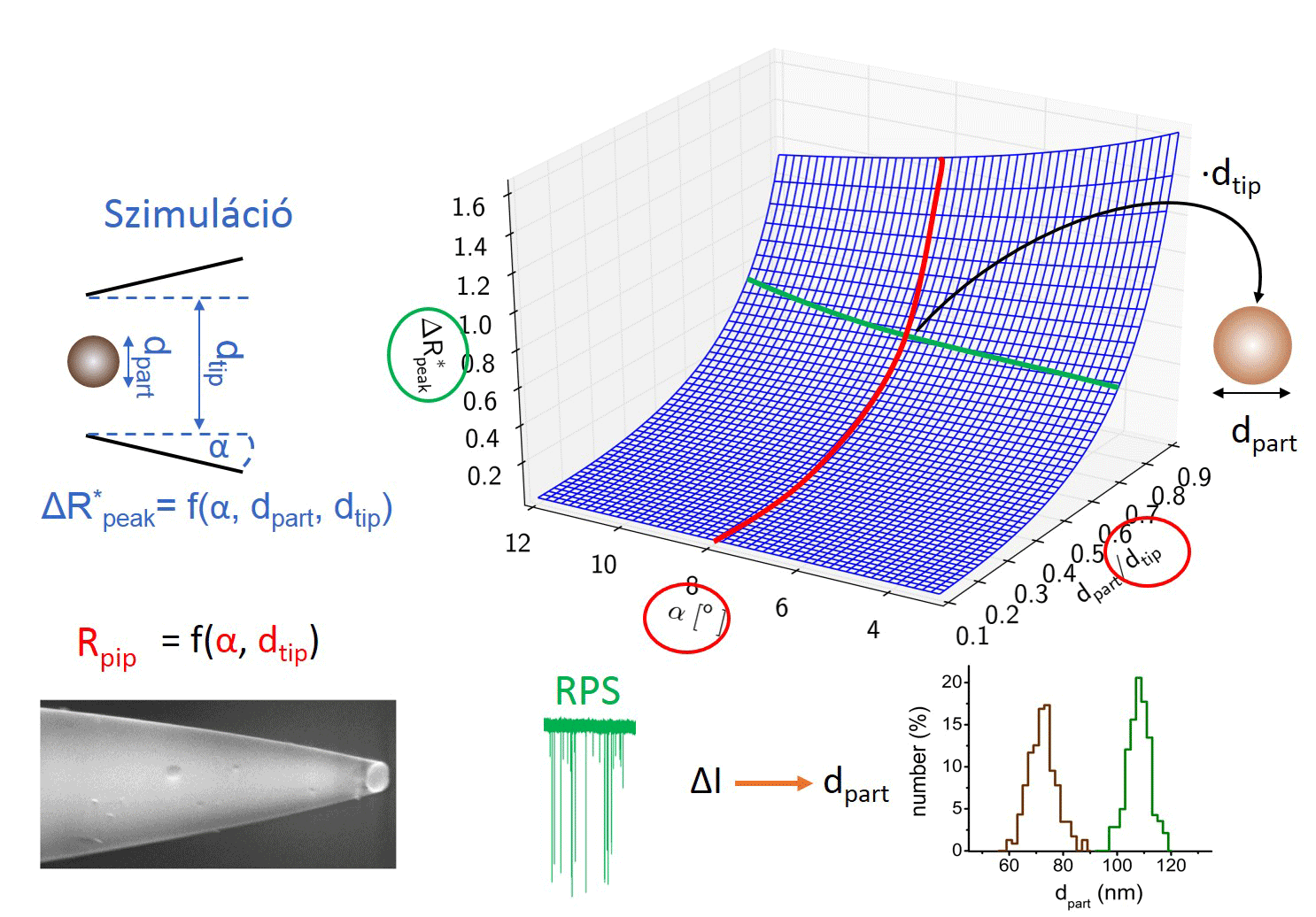
3. ábra: A kalibráció nélküli nanorészecske-méretezés folyamatábrája. [TP1]
A kapott részecskeméret-eloszlásokat dinamikus fényszóráson alapuló méretmeghatározási módszerrel (DLS), pásztázó elektronmikroszkópos képek kiértékelésével (SEM) és nanorészecskemozgás-követő elemzéssel (NTA) validáltam.
A Coulter-számlálóval ellentétben nanopórusokban jóval kisebb térfogatáramok hozhatók létre, ezért nem lehet megmérni, hogy mekkora áteresztett térfogatban detektálható a jelfrekvencia. Emiatt a részecskekoncentráció meghatározásához kalibrációs standardokat használnak.
Ezt elkerülendő, a nanopipetta geometriájának ismeretében megbecsültük a pipetta hidrodinamikai ellenállását (RH). Változtattuk a gőztér nyomását (P az eltérés a légköri nyomástól), mértük a beállított nyomáskülönbségekhez tartozó jelfrekvenciákat (f), és az alábbi lineáris összefüggést felhasználva határoztuk meg a részecskekoncentrációt:
![]()
Az így meghatározott részecskekoncentrációk jó egyezést mutattak a gyártó által megadott részecskesztenderd-koncentrációkkal. [TP1]
Eddigi eredmények
A kapilláris húzókészülék szoftverében a megfelelő paramétert változtatva rendre kisebb átmérőjű kvarc nanopipettákat készítettem, így egyre kisebb nanorészecskék detektálása vált lehetővé. Munkám során a 40–400 nm mérettartományba eső, szintetikus eredetű nanorészecskék számlálására optimált póruskészítési protokollt dolgoztam ki. Ez alapján a csoport poliovírus oltóanyag karakterizálására alkalmas szenzort tudott készíteni.
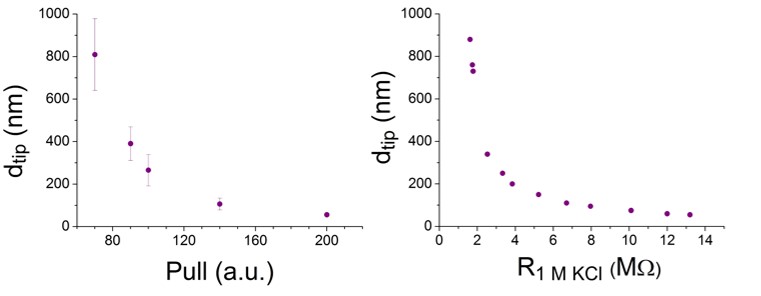
4. ábra: A nanopipetta-átmérő és húzási erő kapcsolata. A pár egyik felét SEM-mel karakterizáltam, a másik felének ellenállását 1 M KCl-ban mértem.
Nagyszámú nanopipettapárt készítettem, és az átmérőt elektronmikroszkópos képekkel vizsgáltam, illetve megmértem az ellenállásukat 1 M KCl-ban. Mivel a SEM-mel vizsgált nanopipettát, nem lehet már RPS-kísérletben felhasználni, illetve az elektrolittal feltöltött pipettát sem lehet SEM-mel vizsgálni, így a pár tagjait eltérő módszerekkel vizsgáltam.
A kúpos geometriájú nanopipettáknál az érzékelőzóna kiszélesedik, és lerövidül. Emiatt a részecskék áthaladása néhány ms hosszú, háromszög alakú áramcsökkenéseket eredményez. Az áramjelek csúcsmaximumait és félértékszélességeit elemezzük:
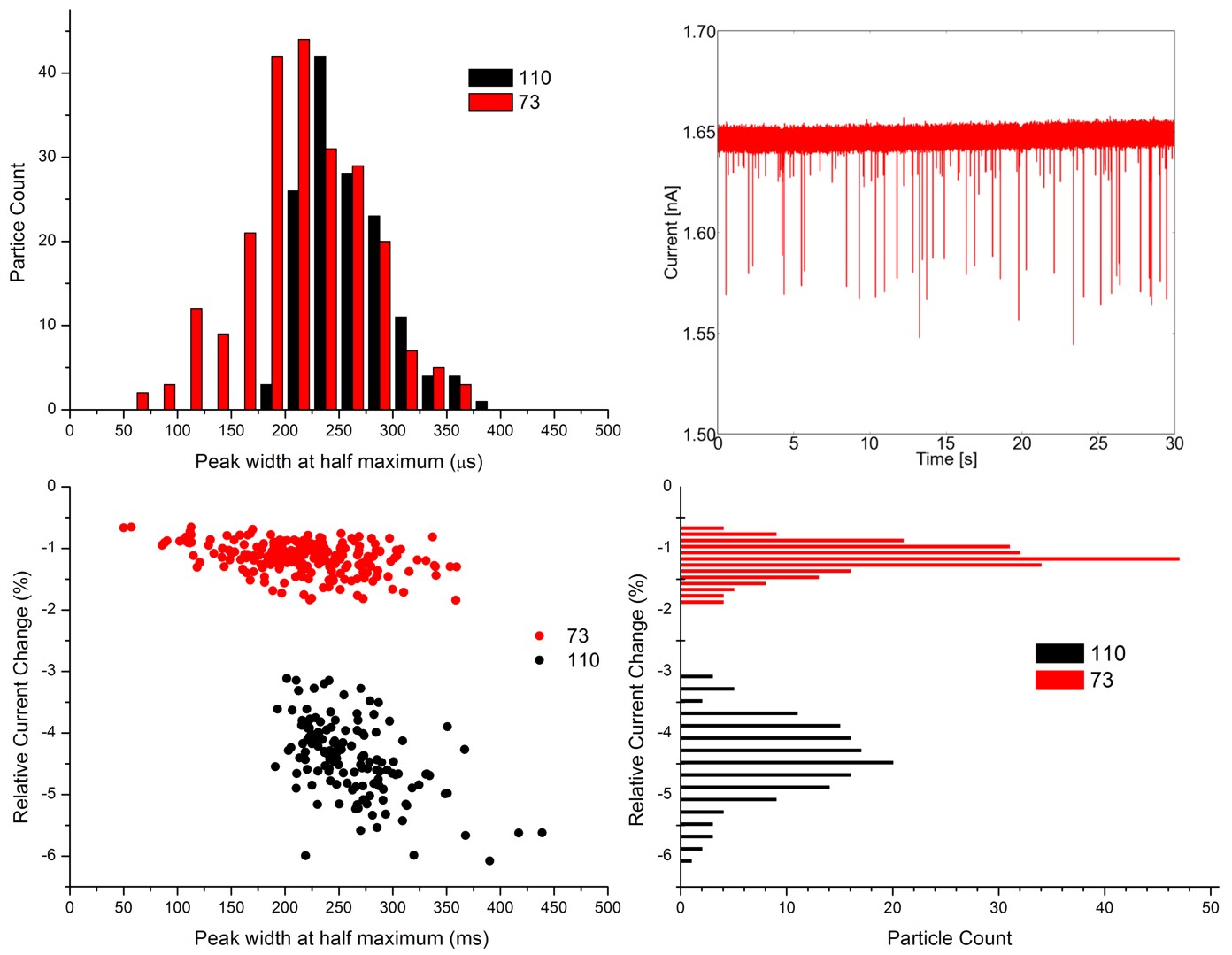
5. ábra: 73 és 110 nm-es részecskék keverékében detektált áramjelek, és a kiértékelt adatok ábrázolása hisztogramokon.
Különböző méretű részecskék monodiszperz oldataiból készült keverékek vizsgálatával igazoltam, hogy a fejlesztett szenzorral folyadékfázisban olyan kis méretkülönbségek is kimutathatók, amelyeket DLS technikával nem észlelünk. A módszer felbontóképessége eléri az elektronmikroszkópiás módszerét:
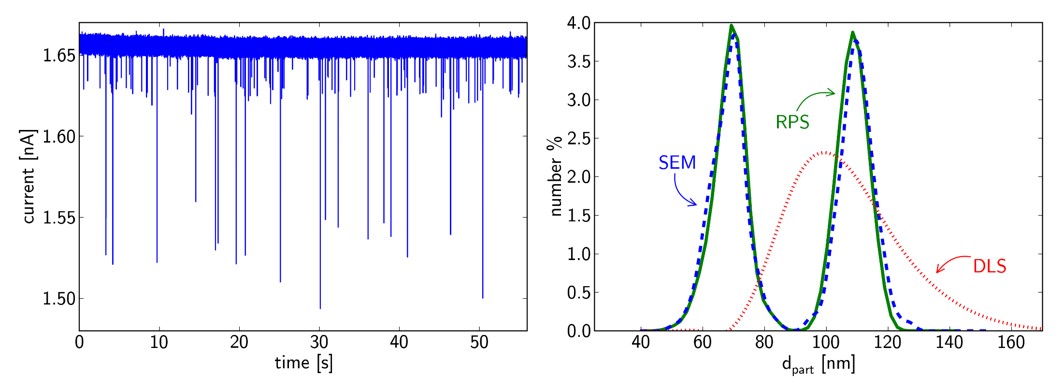
6. ábra: Részecskekeverék RPS-jelei átalakítva részecskeméretté. Az RPS, SEM, és DLS technikákkal mért méreteloszlások összehasonlítva. [TP1]
Polidiszperz oldatokban csak akkor számlálhatók egymás mellett a különböző részecskék, ha alapvonali méretelválasztás valósul meg. Ebben az esetben a fenti térfogatáram változtatásos módszerrel, egymás mellett, kalibráció nélkül határozható meg a különböző méretű részecskék koncentrációja. Ezt felhasználva membránszűrési kísérletekben monitoroztam a részecskekeverékekben bekövetkező koncentráció- és méreteloszlás-változásokat. [TP2]
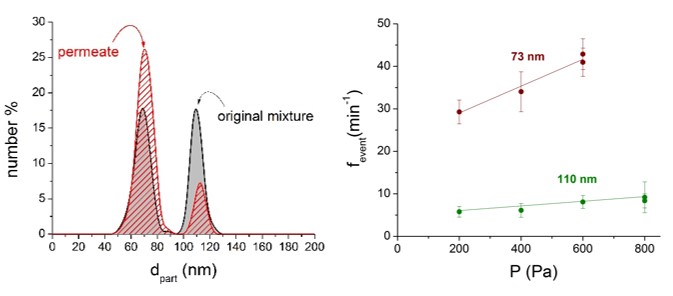
7. ábra: 73 és 110 nm-es részecskekeverék RPS-méreteloszlása membránszűrés előtt és után. A méret szerint elválasztott részecskék fesemény - P meredekség értékei arányosak a permeátumbeli részecskekoncentrációkkal. [TP2]
A bemutatott eredményeket kutatásaim során többek között rotavírusok karakterizálásakor hasznosítottam.
Várható impakt, további kutatás
A kutatócsoportban kidolgozott kalibráció nélküli eljárásunk előnye a kalibráción alapuló módszerekkel szemben, hogy kiküszöböli a méret- és koncentrációstandardok használatát. Ez azért fontos, mert a nanopórusos számlálók egyik hátránya, hogy a nemspecifikus adszorpció miatt a nanorészecskék gyakran a pórus érzékelőzónájában rekednek. Ilyenkor megváltoztatják az alapvonali áramot, növelhetik a zajt, és gátolhatják további részecskék áthaladását. A kalibráló oldatok használata nélkül kevésbé körülményes és gyorsabb az ellenálláspulzus-technikán alapuló nanorészecske-karakterizálási eljárás.
További kutatásaim célja, hogy specifikus felismerő ágens használatával a szelektív részecskeszámlálást megvalósítsam. Ily módon azonos méretű, de különböző anyagi minőségű nanorészecskék egymás mellett is meghatározhatókká válnának.
Saját publikációk, hivatkozások, linkgyűjtemény
[TP1] Terejánszky P, Makra I, Fürjes P, Gyurcsányi RE. Calibration-less sizing and quantitation of polymeric nanoparticles and viruses with quartz nanopipets. ANALYTICAL CHEMISTRY 86:(10) pp. 4688–4697. (2014) IF: 5.636, IC: 9 (doi:10.1021/ac500184z)
[TP2] Terejánszky P, Makra I, Lukács A, Gyurcsányi RE. Nanopipet-Based Resistive Pulse Sensing to Follow Alterations in the Size and Concentration of Nanoparticles During Membrane Filtration. ELECTROANALYSIS 27:(3) pp. 595–601. (2015) IF: 2.471, IC: -
[TP3] Makra I, Terejánszky P, Gyurcsányi RE. A method based on light scattering to estimate the concentration of virus particles without the need for virus particle standards. METHODSX 2: pp. 91–99. (2015) IF: -, IC: 1
Hivatkozások listája.
[1] van den Kieboom CH, van der Beek SL, Mészáros T, Gyurcsányi RE, Ferwerda G, de Jonge MI. Aptasensors for viral diagnostics. TRAC-TRENDS IN ANALYTICAL CHEMISTRY 74: pp. 58–67. (2015)
[2] Coulter WH. Means for counting particles suspended in a fluid. US PATENT No. 2656508 (1953).
[3] Gyurcsányi RE. Chemically-modified nanopores for sensing. TRAC-TRENDS IN ANALYTICAL CHEMISTRY 27:(7) pp. 627–639. (2008)
[4] Luo L, German SR, Lan WJ, Holden DA, Mega TL, White HS. Resistive-Pulse Analysis of Nanoparticles. ANNUAL REVIEW OF ANALYTICAL CHEMISTRY 7:(1) pp. 513–535. (2014)
[5] Bayley H, Martin CR. Resistive-Pulse Sensing – From Microbes to Molecules. CHEMICAL REVIEWS 100:(7) pp. 2575–2594. (2000)
[6] Bubeck D, Filman DJ, Cheng N, Steven AC, Hogle JM, Belnap DM.The Structure of the Poliovirus 135S Cell Entry Intermediate at 10-Angstrom Resolution Reveals the Location of an Externalized Polypeptide That Binds to Membranes. JOURNAL OF VIROLOGY 79:(12) pp. 7745–7755. (2015)
[7] Vogel R, Willmott G, Kozak D, Roberts SG, Anderson W, Groenewegen L, Glossop B, Barnett A, Turner A, Trau M. Quantitative Sizing of Nano/Microparticles with a Tunable Elastomeric Pore Sensor. ANALYTICAL CHEMISTRY 83:(9) pp. 3499–3506. (2011)
[8] Makra I, Gyurcsányi RE. Electrochemical sensing with nanopores: A mini review. ELECTROCHEMISTRY COMMUNICATIONS 43: pp. 55–59. (2014)
Links
Nanoparticle Tracking Analysis
