|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME Vegyészmérnöki és Biomérnöki Kar, Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Balogh-Weiser Diána
Biomimetikus katalizátorrendszer fejlesztése és alkalmazása gyógyszermetabolitok előállításában
A kutatási téma néhány soros bemutatása
A gyógyszerjelölt vegyületek szervezetben történő átalakulásainak (metabolizmus) vizsgálata jellemzően élő szervezetek és belőlük készült sejtes módszerek felhasználásán alapszik. Alternatív lehetőségként jelennek meg a kutatási témám alapjául szolgáló, a szervezet működését utánzó, ún. biomimetikus rendszerek, melyek robusztus módon, a sejtes módszerek számos hátrányát kiküszöbölve képesek metabolitok előállítására.
A kutatóhely rövid bemutatása
Kutatómunkámat a BME Szerves Kémia és Technológia Tanszékén a Bioorganikus Kémiai Kutatócsoportban végzem. Kutatócsoportunkban a biokatalitikus átalakítások nagy múltra tekintenek vissza, szakaszos és folyamatos áramú megvalósítású rendszerekkel. Kutatócsoportunk a BME Lágy Anyagok Kutatócsoportjával együttműködésben biokatalizátor hordozók előállításában, a BME Biomimetikus Technológiák Kutatócsoporttal karöltve rögzített biomimetikus katalizátorok kifejlesztésében vesz részt.
A kutatás történetének, tágabb kontextusának bemutatása
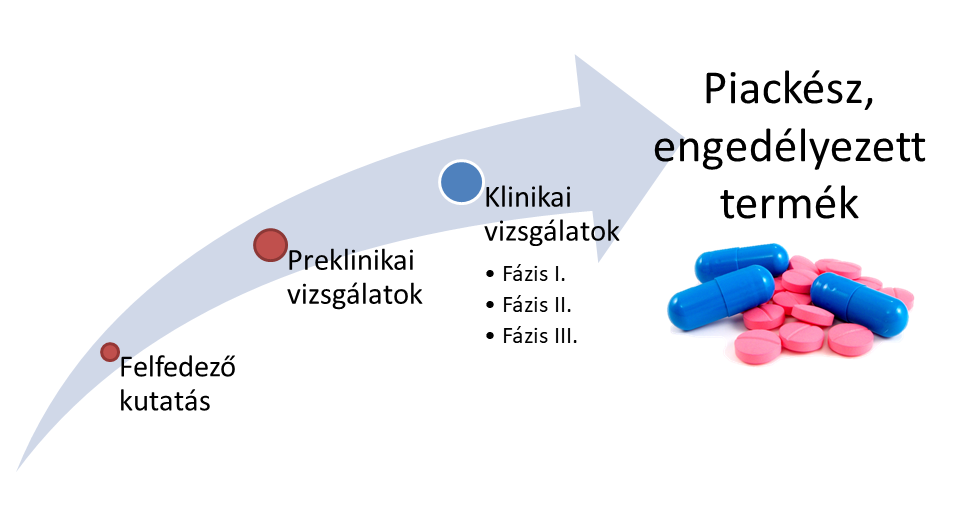
1. ábra: Gyógyszerfejlesztés folyamata1
Új gyógyszerjelölt molekulák (Új Kémiai vagy Biológiai Entitás - NCE vagy NBE) fejlesztése során már a preklinikai szakasz (1. ábra) kezdetén fontos felismerni, hogy a szervezetben történő átalakulások (metabolizmus) hogyan befolyásolják a gyógyszerjelölt vegyületek farmakológiás2 tulajdonságait (farmakodinámia3 - hatásosság, farmakokinetika4 - hatóanyag sorsa a szervezetben). Metabolizmus során kialakulhat főhatás (prodrug- megközelítés), mellékhatás, esetleg toxicitás. [1] A preklinikai vizsgálatok során jellemzően élő szervezetek (állatmodellek) és belőlük készült sejtes módszerek felhasználásával vizsgálják a gyógyszerek szervezetben történő várható átalakulásait. (2. ábra)
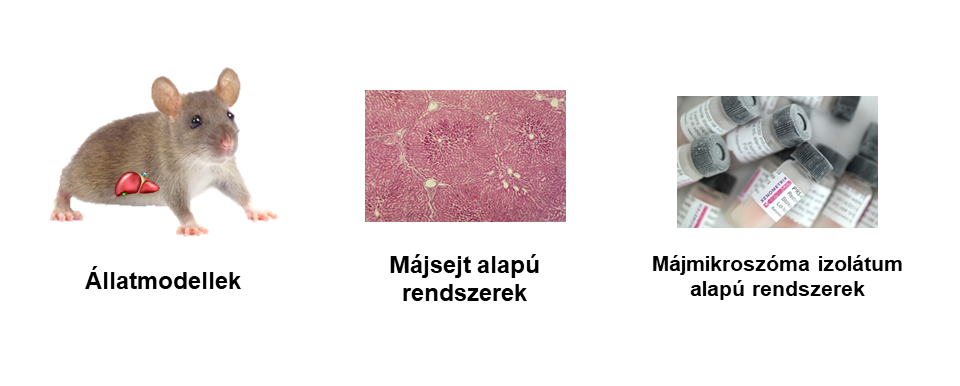
2. ábra: Példák a metabolitkutatásban általánosan használt biológiai rendszerekre
Ezen biológiai módszerek azonban nehézkesek, limitáltak (legtöbbször csak kvantitatív információt adnak), viszonylag drágák, valamint etikai problémákat is felvetnek. [2] Alternatívát jelenthet az ún. biomimetikus rendszerek alkalmazása, amelyek robusztus módon képesek modellezni a szervezetben történő gyógyszer-metabolizmust. Ezen rendszerek egyik ígéretes csoportját alkotják a szintetikus metalloporfirinek5. Alkalmazásuk alapja, hogy szerkezetük hasonló a szervezet gyógyszer-metabolizmusában kitüntetett szerepet játszó hem6-tartalmú fehérjék (CYP4507) aktív helyén található protoporfirin-IX egységhez. [3] (3. ábra)
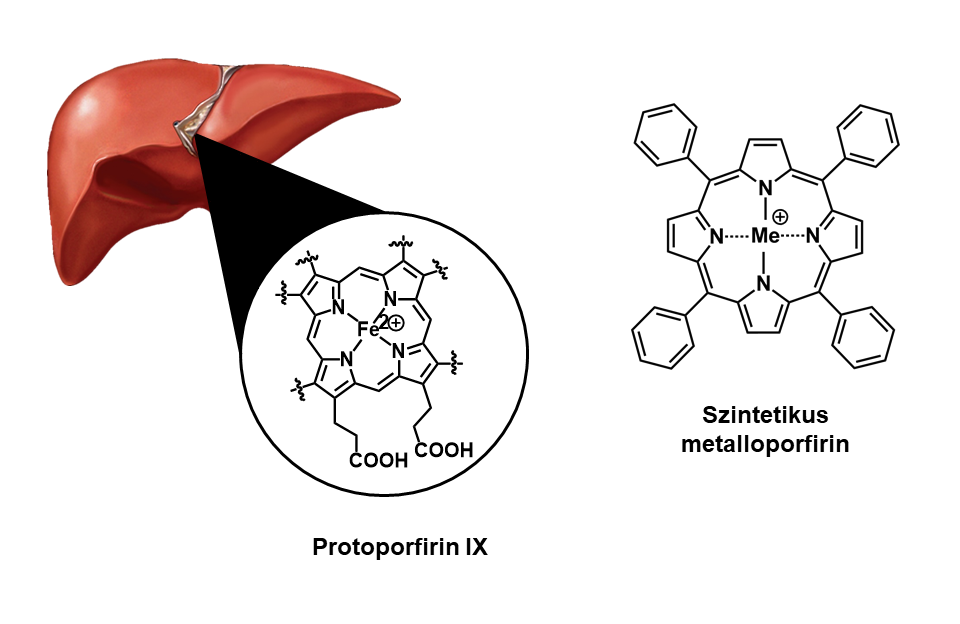
3. ábra: Protoporfirin IX és a szintetikus metalloporfirinek általános szerkezetének összehasonlítása
Elsőként Groves és mtsai alkalmaztak szintetikus metalloporfirineket katalizátorként alkánok8 és olefinek9 hidroxilációs (hidroxilcsoport10 beépülése a molekulába) és epoxidációs11 reakcióiban 1979-ben. [4] Gyógyszer-metabolizmus modellezésére először Chauhan és mtsai alkalmaztak porfirineket az 1990-es évek elején. Az etodolac nevű nem-szteroid típusú gyulladáscsökkentő gyógyszer fő metabolitját állították elő biomimetikus reakcióban. [5]
A kutatás célja, a megválaszolandó kérdések
A hatóságok megkövetelik a szervezetben keletkező metabolitok pontos szerkezetének és biológiai hatásának meghatározását. A jelenleg alkalmazott biológiai rendszerekben csak alacsony koncentrációban keletkeznek metabolitok, emellett a jelenlévő rendkívül komplex biológiai mátrix megnehezíti a minták analitikai vizsgálatát. A metabolitok nagyobb mennyiségű előállítása többnyire csak új szintézisutak kifejlesztésével lehetséges, melyek jelentősen megnövelhetik a fejlesztés idejét és költségeit. Szintetikus metalloporfirinek használatával megoldható mind a kvalitatív analízis (nincs bonyolult biológiai mátrix, valamint nagyobb koncentrációban keletkeznek a metabolitok), mind pedig a nagyobb mennyiségű metabolit előállítása. A reakció körülményeinek (hőmérséklet, oxidálószer és metalloporfirin minősége, pH) szisztematikus változtatásával befolyásolható a keletkező termékelegy összetétele, így eltolható a célvegyület képződésének irányába. A kedvező körülmények meghatározásához szükséges a biomimetikus reakció optimalizálása. A szintetikus metalloporfirinek alkalmazásának hátránya, hogy könnyen degradálódhatnak (például lúgos közegben ún. µ-oxo-dimereket képezhetnek, amelyek a katalizátor inaktiválódását okozhatják [6]), így szükséges a stabilitásuk fokozása. A homogén reakcióvezetéssel elérhető térfogat limitálhatja a metabolitok nagy mennyiségű előállítását, amely kiküszöbölhető lehet nagy mennyiségű katalizátor alkalmazásával, de ez jelentősen növeli az eljárás költségeit. Ezekre a problémákra nyújthat megoldást a metalloporfirinek szilárd hordozóhoz történő rögzítése. A rögzített, metalloporfirin-alapú katalizátorokkal egyedülálló lehetőség nyílik a nagy hatékonyságú, folyamatos áramú reakcióvezetésre. Kutatómunkám során mindezen problémák megoldásával és rögzített hordozós katalizátorok kifejlesztésével foglalkozom.
Módszerek
A felhasznált porfirinek és szilárd hordozók előállítása modern preparatív szerves kémiai módszerekkel történik. A porfirin tisztaságát offline ultraibolya és látható fényt alkalmazó spektrofotometriás (UV-vis)12 módszerrel végezzük, a tisztítás preparatív vékonyréteg-kromatográfiával13 történik. A szilárd hordozók szintézise és módosítása heterogén reakcióközegben történik, optimalizált körülmények között. Gyógyszervegyületek metabolitjainak előállítására alkalmas rendszer fejlesztése több részlépésből épül fel. Az első lépés minden esetben a homogén biomimetikus reakció optimalizálása a korábban ismertetett szempontok alapján. A reakcióelegyeket nagynyomású folyadékkromatográfiával csatolt tömegspektrometriai módszerrel vizsgáljuk (HPLC-MS)14. A reakció termékprofilja és a kiindulási vegyület átalakulási hatékonysága (konverzió) alapján kiválasztjuk az optimális reakciókörülményeket. Minden oxidálószer esetében végzünk referenciakísérleteket katalizátor hiányában, hogy kizárjuk azon eseteket, amelyek során jelentős nem biomimetikus átalakulás történik. Amennyiben nincs szükség nagyobb mennyiségű metabolit előállítására, és csupán a keletkezett metabolitok szerkezetének azonosítása a cél, preparatív vékonyréteg kromatográfiával vagy preparatív nagynyomású folyadékkromatográfiával (preparatív HPLC)15 elválasztjuk a keletkezett metabolitokat. A szerkezetmeghatározás nagy felbontású tömegspektrometriás (HRMS)16 valamint mágnesesmagrezonancia-méréssel (NMR)17 történik. Amennyiben nagyobb mennyiségű metabolit előállítása a cél (hatásvizsgálat, egyéb cél) a következő lépés az optimálisnak talált porfirin minőségének megfelelő szilárd hordozó kiválasztása heterogén szakaszos reakciókban. Ezen lépés során HPLC-MS módszerrel vizsgáljuk a katalizátor aktivitását. Az ezt követő lépés során az optimálisnak talált heterogén szakaszos rendszert áramlásos reakcióvezetés mellett is megvalósítjuk. A folyamatos áramú rendszer gyors optimalizálását in-line UV-vis, valamint Raman-spektroszkópiás18 módszerrel végezzük. A reakcióelegy vizsgálata HPLC-MS módszerrel, a kívánt anyag elválasztása preparatív HPLC módszerrel történik. Referenciaként elvégezzük a gyógyszervegyületek egér, patkány és humán májmikroszómás19 vizsgálatát. A mikroszómával kezelt reakcióelegyeket a már korábban említett HPLC-MS technikával vizsgáljuk. A mikrofluidikai chipen átáramoltatott reakcióelegy vizsgálatára csatolt HPLC-MS technikát alkalmazunk.
Eddigi eredmények
Kutatócsoportunkban korábban számos gyógyszermolekula biomimetikus oxidációját végezték el szakaszos és folyamatos áramú reakcióvezetés mellett, nem vizsgálták azonban a reakció körülményeinek befolyásoló hatását. Kutatásom korai szakaszában a reakcióközeg kémhatásának, valamint az oxidálószer minőségének hatását vizsgáltam a biomimetikus reakcióra, Amiodaron szívritmuszavar-betegség kezelésében használt gyógyszert alkalmazva modellvegyületként. Homogén reakcióban három különböző oxidálószert (hidrogén-peroxid - H2O2, terc-butil-hidroperoxid - tBuOOH, nátrium-perjodát - NaIO4) vizsgáltam, valamint savas (pH=2,7) és enyhén lúgos (pH=7,4) között változtattam a reakcióelegy kémhatását. A körülmények szisztematikus változtatásával sikerült az Amiodaron gyógyszer eddig nem azonosított metabolitjainak a szerkezetét bizonyítani.
4. ábra: Homogén reakció általános bemutatása
Homogén reakcióban azonban a katalizátor élettartamának rövidsége miatt nagyobb mennyiségű metabolit előállítására nem volt lehetőség. Az optimális reakciókörülményeket kiválasztva (pH = 4,5, tBuOOH oxidálószer) folyamatos áramú rendszerbe kívántam a rendszert átültetni, amely alkalmas nagy mennyiségű metabolit előállítására. Ennek érdekében megfelelő szilárd hordozó fejlesztésére volt szükség, amely jó hatékonysággal képes megkötni az alkalmazott porfirin katalizátort. A céljainknak megfelelő szilárd hordozónak az aminocsoportokkal felületmódosított mezopórusos szilikagél bizonyult, amely felületére ionos kölcsönhatással rögzül a katalizátor.
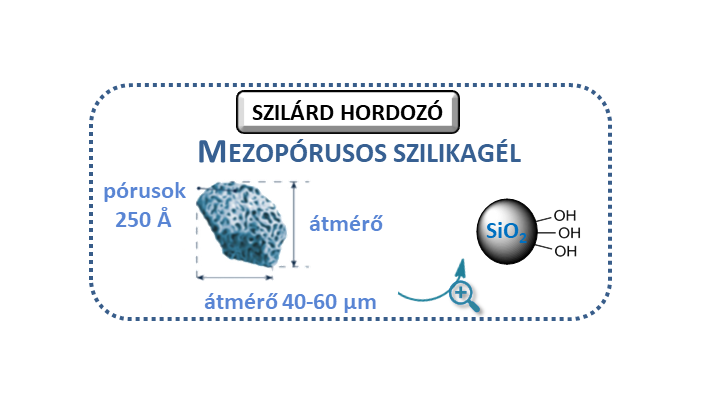
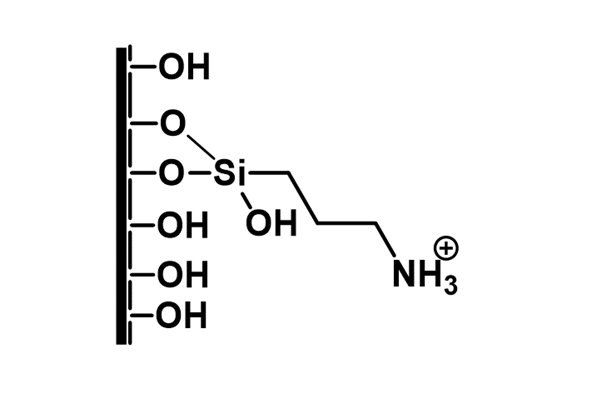
5. ábra: Mezopórusos szilika tulajdonságai és a módosított felület
A hordozót egy csőreaktorba töltöttem. A katalizátor rögzítése folyamatos áramban történt, amely tovább javította a rendszer használhatóságát. A hordozó felületén a teljes katalizátor mennyiség megkötődött.
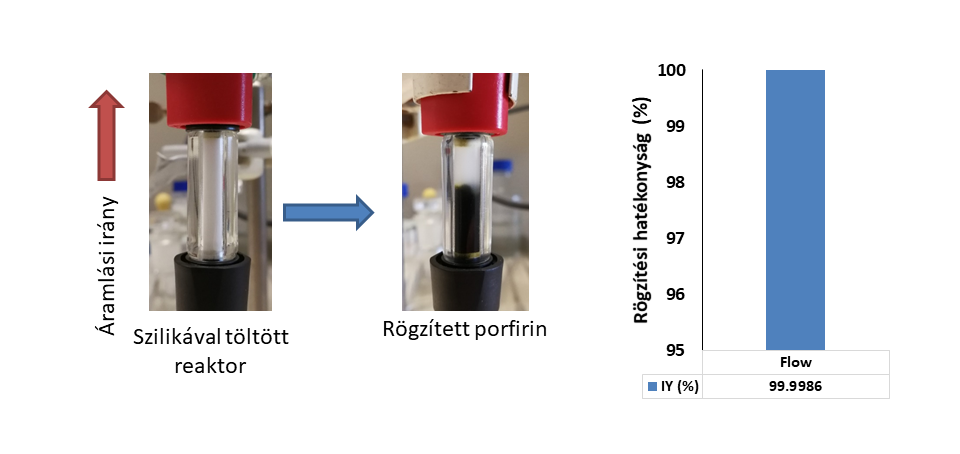
6. ábra: Porfirin katalizátor folyamatos áramú rögzítése és a rögzítési hatékonyság értéke
Vizsgáltam az áramlási sebesség és az oxidálószer mennyiségének hatását a folyamatos áramú biomimetikus reakcióra. Az optimális körülmények alkalmazásával több mint 50 órán keresztül jelentős aktivitáscsökkenés nélkül folyt a reakció. Végül a rendelkezésre álló rendszerek metabolit-előállító képességét hasonlítottam össze. Mindhárom rendszert az ún. volumetrikus produktivitással jellemeztem, amely megadja az egységnyi reaktortérfogatban egységnyi idő alatt előállítható termék tömegét. Az általunk kifejlesztett folyamatos áramú rendszer egy nagyságrenddel nagyobb volumetrikus produktivitásra képes, mint a korábban kifejlesztett, illetve a szakaszos rendszer.
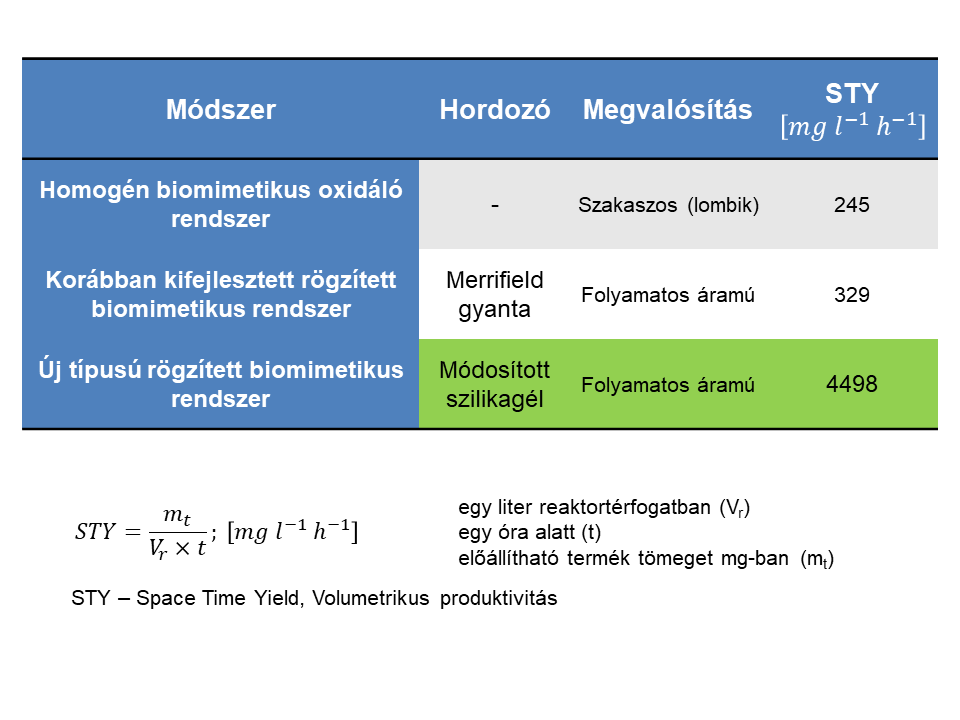
7. ábra: Volumetrikus produktivitás és a rendszerek összehasonlítása
A gyógyszerkutatásban gyors analitikai információ szerzése egyre fontosabbá válik. Erre megoldást jelenthet az ún. mikrofluidikai chipek használata, amelyek kis anyagmennyiség felhasználásával rövid idő alatt képesek információt szolgáltatni. Kutatómunkám második felében egy májat utánzó mikrofluidikai chipreaktor (Liver-on-a-chip) kifejlesztését tűztük ki célul. Kulcskérdés olyan a megfelelő szilárd hordozó megtalálása, amely alkalmas az egyszerű, gyors csapdázásra a mikrofluidikai chipben. Erre a célra az ún. mágneses nanorészecskék (MNP) használata célravezető, mivel mágneses tulajdonságaik miatt egy egyszerű mágnessel megoldható a reaktorban való rögzítésük. Az általunk kifejlesztett chip megfelelő analitikai technikával kapcsolva (HPLC-MS) akár 10 perc alatt képes metabolitok előállítására és azonosítására.
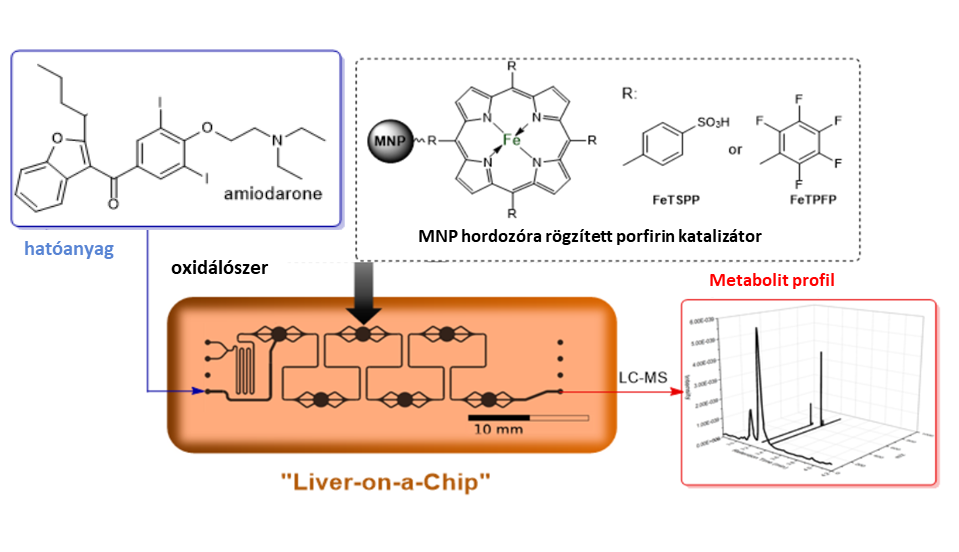
8. ábra: A mikrofluidikai reakció általános bemutatása

9. ábra: Mikrofluidikai chip használatban
Várható impakt, további kutatás
Kutatómunkám során kifejlesztettem egy biomimetikus rendszert, amely alkalmazható metabolitok szintézisére, ezáltal eddig még nem azonosított vagy a biológiai mátrix miatt nem detektálható metabolitok szerkezetét azonosíthatjuk. Kiválthatóvá válik a hatóság által megkövetelt hatásvizsgálatokhoz szükséges metabolitok totálszintézissel való előállítása, ami gyorsíthatja a gyógyszerfejlesztés folyamatát. Új, a szervezetben nem képződő metabolitok előállításával és vizsgálatával szélesíthetjük az elérhető kémiai teret, és jobb tulajdonságú gyógyszerek kifejlesztése válhat lehetségessé.
További kutatómunkámban a biomimetikus oxidációt befolyásoló tényezők mélyrehatóbb vizsgálatát tűztem ki célul, amelyek képesek a reakció szelektivitását javítani. Emellett fokozni kívánom az érzékeny porfirin katalizátor stabilitását, ami a folyamatos áramú reakció produktivitását javíthatja.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája.
[S1] Decsi, B.; Krammer, R.; Hegedűs, K.; Ender, F.; Gyarmati, B.; Szilágyi, A.; Tőtős, R.; Katona, G.; Paizs, Cs.; Balogh, Gy., T.; Poppe, L.; Balogh-Weiser, D. Liver-on-a-Chip‒Magnetic Nanoparticle Bound Synthetic Metalloporphyrin-Catalyzed Biomimetic Oxidation of a Drug in a Magnechip Reactor. Micromachines 2019, 10, 668.
DOI: 10.3390/mi10100668
[S2] Fődi, T.; Ignácz, G.; Decsi, B.; Béni, Z.; Túrós, G.I.; Kupai, J.; Weiser, D.B.; Greiner, I.; Huszthy, P.; Balogh, Gy.T. Biomimetic Synthesis of Drug Metabolites in Batch and Continuous-Flow Reactors. Chem. - A Eur. J. 2018, 24, 9385–9392.
Linkgyűjtemény.
1. https://www.magyosz.org/hu/oldal/gyogyszerfejlesztes
2. https://hu.wikipedia.org/wiki/Farmakol%C3%B3gia
3. https://hu.wikipedia.org/wiki/Farmakol%C3%B3gia#Farmakodin%C3%A1mia
4. https://hu.wikipedia.org/wiki/Farmakol%C3%B3gia#Farmakokinetika
5. https://hu.wikipedia.org/wiki/Porfin
6. https://hu.wikipedia.org/wiki/Hem
7. https://hu.wikipedia.org/wiki/Citokr%C3%B3m_P450
8. https://hu.wikipedia.org/wiki/Alk%C3%A1nok
9. https://hu.wikipedia.org/wiki/Alk%C3%A9nek
10. https://hu.wikipedia.org/wiki/Hidroxilcsoport
11. https://hu.wikipedia.org/wiki/Epoxidok#El%C5%91%C3%A1ll%C3%ADt%C3%A1sa
12. http://www.vilaglex.hu/Fizika/Html/UVViSpek.htm
14. http://tamop412a.ttk.pte.hu/files/kemia7/www/ch10s02.html
15. https://hu.wikipedia.org/wiki/HPLC
16. https://hu.wikipedia.org/wiki/T%C3%B6megspektrometria
17. https://hu.wikipedia.org/wiki/M%C3%A1gneses_magrezonancia
18. http://www2.sci.u-szeged.hu/inorg/MOMA/ch07s02.html
19. https://hu.thpanorama.com/articles/biologa/microsomas-caractersticas-tipos-y-funciones.html
Hivatkozások listája.
[1] Han, H., Amidon, G.L. Targeted prodrug design to optimize drug delivery. AAPS PharmSci 2, 48–58 (2000).
https://doi.org/10.1208/ps020106
[2] 1. Bernadou, J.; Meunier, B. Biomimetic Chemical Catalysts in the Oxidative Activation of Drugs. Adv. Synth. Catal. 2004, 346, 171–184.
DOI: 10.1002/adsc.200303191
[3] Lohmann, W., Karst, U. Biomimetic modeling of oxidative drug metabolism. Anal Bioanal Chem 391, 79–96 (2008).
10.1007/s00216-007-1794-x
[4] John T. Groves and Robert Quinn, J. Am. Chem. Soc. 1985 107 (20), 5790-5792
DOI: 10.1021/ja00306a029
[5] Chauhan SM, Kandadai SA, Sahoo B. Regioselective biomimetic oxidation of etodolac with iodosylbenzene catalyzed by halogenated and perhalogenated metalloporphyrins in dichloromethane. Chem Pharm Bull (Tokyo). 2001;49(10):1375-1376.
DOI:10.1248/cpb.49.1375
[6] Wolak, M. and van Eldik, R. (2007), Mechanistic Studies on Peroxide Activation by a Water‐Soluble Iron(III)–Porphyrin: Implications for OO Bond Activation in Aqueous and Nonaqueous Solvents. Chemistry – A European Journal, 13: 4873-4883.
DOI:10.1002/chem.200601148