|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
BME Vegyészmérnöki és Biomérnöki Kar, Szerves Kémia és Technológia Tanszék
Témavezető: Dr. Nagy Zsombor Kristóf
Integrált folyamatos gyógyszertechnológiák fejlesztése
A kutatási téma néhány soros bemutatása
A nagy iparágak közül a gyógyszeripar az utolsó, mely a mai napig hagyományos szakaszos technológiákkal állítja elő a termékeit. Ennek az elavult berendezkedésnek számos hátránya van, például a nehéz méretnövelés vagy a rugalmatlan és lassú gyártás. Habár immár nagyszámú publikáció született a folyamatos gyógyszer-technológiák területén, ezek túlnyomó többsége egy-egy különálló lépést vizsgál, és az ipari alkalmazáshoz elengedhetetlen technológiai integrálás nagyon kevés munkában valósult meg. A kutatómunkában különböző folyamatos gyógyszer-technológiák közvetlen összekapcsolását, és a kapcsolásból fakadó újfajta kihívásokat vizsgáltunk, lefedve a teljes gyártási láncot a kiindulási anyagoktól a végtermékekig.
A kutatóhely rövid bemutatása
A kutatást a Vegyészmérnöki és Biomérnöki Kar Szerves Kémia és Technológia Tanszékén, Dr. Marosi György és Dr. Nagy Zsombor Kristóf irányításával végeztük. Az általuk vezetett Firepharma Kutatócsoportban számos, nemzetközi érdeklődést kiváltó publikáció született a folyamatos gyógyszer-technológiák területén.
A kutatás történetének, tágabb kontextusának bemutatása
Az elmúlt évtizedek gyógyszeripari innovációja szinte kizárólag az új gyógyszerek kutatására és fejlesztésére korlátozódott, miközben a termelés struktúrája évtizedek óta változatlanul az elavult szakaszos technológiákon alapul. A szakaszos műveletek folyamatos technológiákra való lecserélésével azonban gyorsabb, olcsóbb, rugalmasabb termelés építhető ki a termékek minőségének lényegesen jobb színvonalon történő biztosításával [1]. Ezt felismerve a fő gyógyszerügyi hatóságok irányelvek közzétételével bátorítani kezdték a vállalatokat folyamatos technológiák fejlesztésére és alkalmazására. Ennek eredményeképpen mára kiterjedt kutatás zajlik különféle gyógyszer-technológiákkal a szintézistől egészen a végső gyógyszerforma kialakításáig. A kutatások azonban túlnyomó többségében az egyes gyártási lépéseket külön-külön, izoláltan tanulmányozzák. A folyamatos technológiák előnyeinek teljes körű kiaknázása érdekében a szeparált folyamatokat össze kell kapcsolni a lépések közti megállás csökkentése érdekében. A témában megjelent publikációk számából kiindulva akár csak két technológiai lépés összekötése is nagy kihívást jelent.
A folyamatos gyógyszer-technológiák fejlesztésének végső célja úgynevezett „end-to-end” rendszerek fejlesztése lenne, melyekben a kiindulási anyagoktól kezdve a végső gyógyszerformáig egy folyamatos rendszerben megszakítás nélkül áramlanak az anyagok. Az irodalomban csupán néhány példa található gyógyszertermékek „end-to-end” módon történő előállítására, melyekben összekapcsolták egy hatóanyag áramlásos szintézisét a gyógyszerkészítmény folyamatos előállításával. Ezekben a példákban az előállított végső gyógyszerforma vagy fröccsöntött tabletta [2] vagy vizes oldat volt [3].
A kutatás célja, a megválaszolandó kérdések
A kutatás külföldi kutatócsoportokkal és gyógyszergyárakkal együttműködésben valósul(t) meg. A szakirodalom integrált folyamatos gyógyszer-technológiákkal, illetve „end-to-end” folyamatos rendszerekkel kapcsolatos területének feltérképezése után a kísérleti munka fő célkitűzései már megfogalmazhatóak voltak. Szerettünk volna folyamatos, „end-to-end” rendszereket fejleszteni úgy, hogy a hagyományos gyógyszergyártási lépéseket mind folyamatos üzemben végezzük el, közvetlen módon összekapcsoljuk őket, és vizsgáljuk az integrálásból eredő újfajta kihívásokat, a gyártás hosszabb távú stabilitását. Ennek megfelelően áramlásos rendszerű szintézis, folyamatos kristályosítás és szűrés, illetve a kristálypor folyamatos adagolása és homogenizálása voltak a kifejlesztendő technológiai lépések. Emellett egy, az iparban eddig széles körben nem alkalmazott, ám eredendően folyamatos működésű technológiát, az elektrosztatikus szálképzést kívántuk tesztelni, egy gyógyszerhatóanyag folyamatos áramlásos szintézisének közvetlen feldolgozására. A munkák végcélja végső gyógyszerformák előállítása volt: új, innovatív, szájban oldódó gyógyszerkészítmény a szálképzett termékből, illetve az irodalomban korábban még nem publikált, de az iparban legelterjedtebb hagyományos, préselt tabletta.
Módszerek
A választott modellhatóanyag, acetilszalicilsav folyamatos áramlásos szintézisét PTFE csövekből készült mikroreaktorokban fejlesztettük és optimalizáltuk, melyekben nagynyomású precíziós pumpákkal adagoltuk a folyadékokat.
A reakcióelegy kristályosítását hagyományos, kevert tartályreaktorban végeztük folyamatos anyagbetáplálással és termékelvétellel. Az oldatok beadagolására perisztaltikus pumpákat használtunk, míg az előállított szuszpenziót a reaktorból egy folyamatos üzemű szűrőberendezés (Continuous Filtration Carousel, CFC) anyagmozgató mechanizmusán keresztül vezettük el, így közvetlenül a következő, szűrési lépésbe juttatva azt. A CFC-be vákuum segítségével adagoltuk be a szuszpenziót kicsi, 10 ml-es adagokban. A szűrés folyamata a berendezésben rövid, automatizált ciklusokban zajlott.
A leszűrt hatóanyagot és a tablettázáshoz szükséges segédanyagot, a mikrokristályos cellulózt csigás poradagolókkal folyamatosan dozíroztuk egy ikercsigás homogenizáló készülékbe. Az így előállított porhomogenizátumot futószalaggal elszállítottuk egy tablettázó berendezésbe, ahol folyamatos üzemben tablettákká préseltük az anyagot.
Az áramlásos szintézis reakcióelegyét folyamatos kristályosítás mellett elektrosztatikus szálképzéssel is feldolgoztuk. Ennél az eljárásnál szükség volt egy hatóanyag mellett oldott polimer segédanyagra, melyet a szintézis során bejuttattunk a rendszerbe. A szintézis után a cső végére erősített fém szórófejre nagyfeszültséget kapcsoltunk. A nagy elektromos térerősség hatására a viszkózus oldatból nanoszálak képződtek az oldószer elpárolgása mellett. Egy folyamatos gyártóberendezést fejlesztettünk, melyben az előállított szálas terméket egy folyamatosan mozgó hordozó filmen gyűjtöttük, és az elvezetett kétrétegű szalagot egy automatizált vágómechanizmussal kisebb, beteg által bevehető egységekre vágtuk.
A kifejlesztett folyamatokat és az előállított termékeket számos analitikai módszerrel vizsgáltuk: folyadékkromatográfia, Raman és NIR spektroszkópia, pásztázó elektronmikroszkópia, differenciális pásztázó kalorimetria, tömegspektrometria, mágneses magrezonancia, gélpermeációs kromatográfia, por-röntgendiffrakció, in vitro kioldódási vizsgálat és lézerdiffrakció a szemcseméret-eloszlás meghatározására.
Eddigi eredmények
Az acetilszalicilsav szintézisét áramlásos reaktorokban valósítottuk meg két egymást követő reakciólépésben. A reagensek, oldószerek és a katalizátor kiválasztásánál fontos szempont volt, hogy a végső reakcióelegy feldolgozható legyen elektrosztatikus szálképzéssel, aminek fő kritériuma az egyes anyagok jó illékonysága. Kísérlettervezés segítségével a két szintetikus lépést optimalizáltuk, így nagy termeléssel és tisztasággal kaptuk a hatóanyagot további tisztítási lépés nélkül is (>95%). A megfelelő mennyiségű polimer segédanyagot a folyadékáramba juttatva a második reakciólépés előtt, majd nagyfeszültséget kapcsolva a végső reakcióelegyre kiváló minőségű nanoszálakba tudtuk ágyazni az előállított acetilszalicilsavat. Megépítettünk egy gyártóberendezést, melyben a szálakat egy hordozó filmen gyűjtöttük folyamatos módon, és az így kialakított kettős rétegű szalagot egy vágómechanizmus felé vezettük el, ahol kisebb egységekre vágtuk azt (1. ábra). A gyógyszerforma in vitro kioldódásának vizsgálata során pillanatszerű oldódást tapasztaltunk, így megfelelő lehet szájüregben való alkalmazásra.

1. ábra: 30 x 30 mm-es öntött film hordozó (a) és a rajta összegyűjtött szálas termék (b).
A folyamatos gyártás stabilitását 8 és 24 órás kísérletekben teszteltük, melyek során demonstrálni tudtuk a szintézis, a szálképzés és a szálak hordozón való gyűjtésének pontosságát a termékek tisztaságán, alacsony maradékoldószer-tartalmán és hatóanyag-tartalmának egységességén keresztül. A végső rendszer sematikus rajza a 2. ábrán látható.
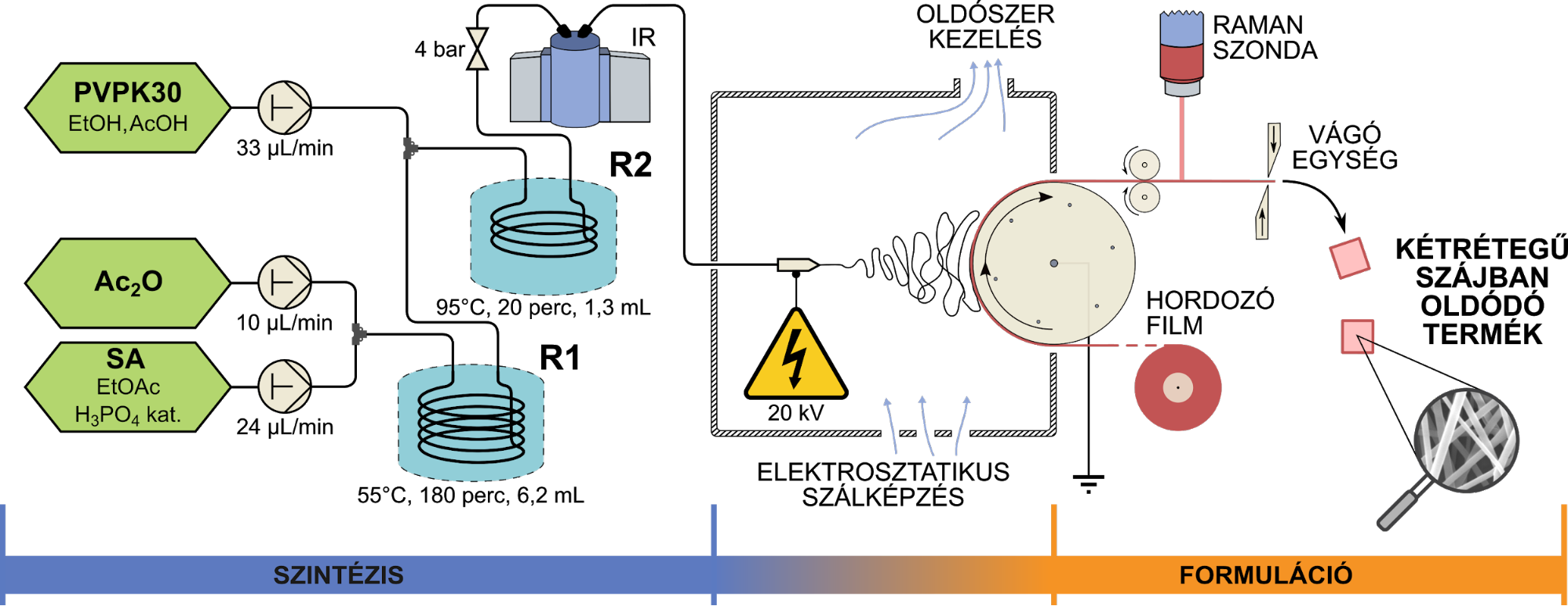
2. ábra: A szálképzett, szájban oldódó gyógyszerkészítmény folyamatos gyártására kifejlesztett rendszer vázlatos rajza. R1 és R2 áramlásos reaktorok, IR egy átfolyó cellás Bruker FTIR készülék, illetve Kaiser Raman PhAT szondát alkalmaztunk monitorozásra.
Az áramlásos szintézis reakcióelegyét folyamatos kristályosítással is sikeresen feldolgoztuk, és a kikristályosított hatóanyagot közvetlen módon továbbvittük egy folyamatos szűrési lépésbe. A folyamatos kristályosítás során heptánt használtunk kicsapószerként. A reaktor hőmérsékletének és tartózkodási idejének módosításával vizsgáltuk, hogyan változik a szűrt anyag minősége a maradékoldószer-tartalom, a termelés és a szemcseméret-eloszlás szempontjából. Az eredmények azt mutatták, hogy a nedvességtartalmat mindkét paraméter (3. ábra), míg a kristályméretet és kihozatalt elsősorban a kristályosító hőmérséklete befolyásolta.
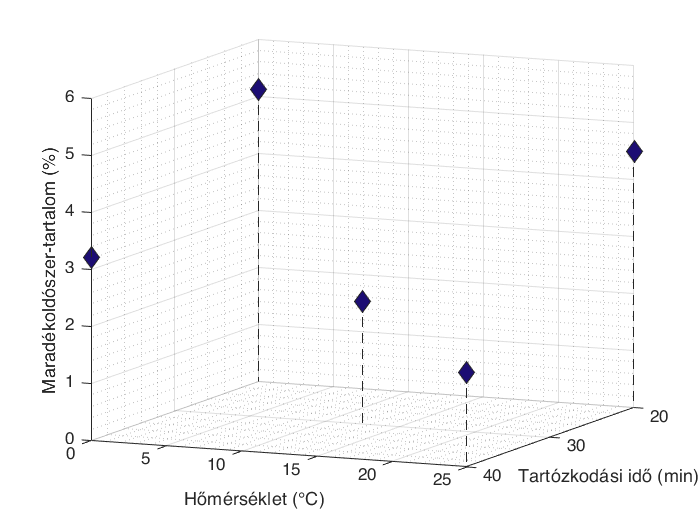
2. ábra: A folyamatosan szűrt kristályos termék maradékoldószer-tartalmának változása a folyamatos kristályosító hőmérsékletének és tartózkodási idejének függvényében.
Fontos megfigyelés volt, hogy a folyamatos szűrőben az összes vizsgált beállításnál jó folyási tulajdonságú kristályos termék keletkezett, amely kiválóan alkalmas volt poradagolási és homogenizálási lépésekben való felhasználásra (4. ábra).

4. ábra: Acetilszalicilsav és mikrokristályos cellulóz adagolása a folyamatos homogenizálóba (bal); NIR szonda a hatóanyag-tartalom követésére a homogenizáló után (középen); futószalag és tablettázógép a porhomogenizátum tablettákká való alakítására (jobb).
Ezeket a lépéseket egy közeli infravörös (NIR) spektroszkópiás szondával követtük valós időben, és az eredmények azt mutatták, hogy a folyamatos homogenizálás során egy rövid felfutási szakaszt követően a porhomogenizátum acetilszalicilsav-tartalma elfogadható ingadozással beállt a célérték 20%-ra. A következő lépésben előállított tabletták hatóanyag-tartalmát a gyártást követően hasonló módon mérve nagyon hasonló átlagos acetilszalicilsav-tartalmat és kicsi szórást kaptunk, mely megfelelt a tablettákra vonatkozó hatósági előírásoknak (5. ábra). Így elsőként sikerült bebizonyítani a legelterjedtebb gyógyszerforma, a préselt tabletta „end-to-end” folyamatos gyártásának megvalósíthatóságát.
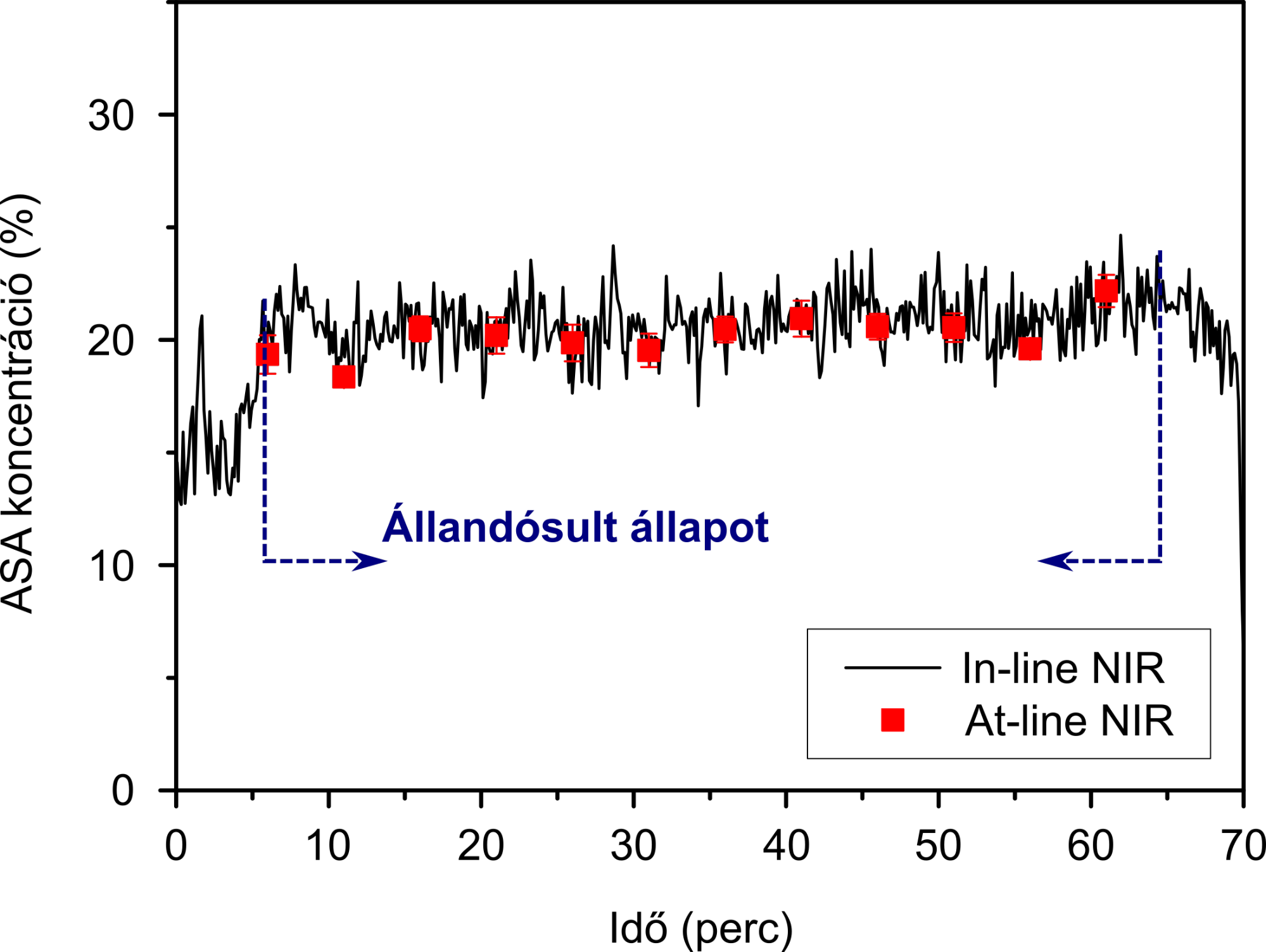
5. ábra: Az acetilszalicilsav (ASA) in-line NIR-spektroszkópiásan mért koncentrációja a porkeverékben, illetve az állandósult állapotban gyártott tabletták hatóanyagtartalom-mérésének az eredménye.
Várható impakt, további kutatás
A bemutatott munkában számos folyamatos műveletet fejlesztettünk ki a hatóanyag szintézisétől a végső gyógyszerforma kialakításáig. Ezekben a hangsúlyt az egyes lépések összekapcsolhatóságára fektettük, és vizsgáltuk a folyamatok különböző paramétereinek a közvetlen kapcsolásból fakadó kölcsönhatását. A gyógyszeripari folyamatos technológiák ily módon való fejlesztése mindeddig csak elvétve volt megtalálható az irodalomban. Ez a megközelítés megkönnyítheti a folyamatos rendszerek gyógyszeripari alkalmazását és hozzájárulhat a folyamatos gyógyszergyártás elterjedéséhez.
A kutatás folytatásában szeretnénk további hatóanyagokkal dolgozni a kifejlesztett folyamatokban, illetve további gyógyszergyártási lépéseket vizsgálni, például a folyamatos nedves granulálást és folyamatos szárítást, mely területek nagy érdeklődést válthatnak majd ki a témában jártas szakemberek körében.
Saját publikációk
Közvetlenül kapcsolódó saját publikációk listája
[I] A. Balogh, A. Domokos, B. Farkas, A. Farkas, Z. Rapi, D. Kiss, Z. Nyiri, Z. Eke, G. Szarka, R. Örkényi, B. Mátravölgyi, F. Faigl, G. Marosi, Zs. K. Nagy, Continuous end-to-end production of solid drug dosage forms: coupling flow synthesis and formulation by electrospinning, Chemical Engineering Journal, 350 (2018), 290-299.
IF: 8,355 C: 32
[II] A. Domokos, A. Balogh, D. Dénes, G. Nyerges, Z. Levente, B. Farkas, G. Marosi, Zs. K. Nagy, Continuous manufacturing of orally dissolving webs containing a poorly soluble drug via electrospinning, European Journal of Pharmaceutical Sciences, 130 (2019), 91-99.
IF: 3,616 C: 8
[III] Y. C. Liu, A. Domokos, S. Coleman, P. Firth, Z. K. Nagy, Development of continuous filtration in a novel continuous filtration carousel integrated with continuous crystallization, Organic Process Research & Development, 23, 12 (2019), 2655–2665
IF: 3,023 C: 1
[IV] A. Domokos, B. Nagy, M. Gyürkés, A. Farkas, K. Tacsi, H. Pataki, Y. C. Liu, A. Balogh, P. Firth, B. Szilágyi, G. Marosi, Z. K. Nagy, Zs. K. Nagy, End-to-end continuous manufacturing of conventional compressed tablets: from flow synthesis to tableting through integrated crystallization and filtration, International Journal of Pharmaceutics, 581 (2020), 119297.
IF: 4,845 C: 0
Közvetetten kapcsolódó publikációk listája
[V] E. Borbás; B. Sinko, O. Tsinman, K. Tsinman; É. Kiserdei, B. Démuth, A. Balogh, B. Bodák, A. Domokos, G. Dargó, G. Balogh, Zs. K. Nagy, Investigation and mathematical description of the real driving force of passive transport of drug molecules from supersaturated solutions, Molecular Pharmaceutics, 13, 11 (2016), 3816–3826.
IF: 5,037 C: 38
[VI] A. Balogh, B. Farkas, Á. Pálvölgyi, A. Domokos, B. Démuth, G. Marosi, Zs. K. Nagy, Novel alternating current electrospinning of hydroxypropylmethylcellulose acetate succinate (HPMCAS) nanofibers for dissolution enhancement: the importance of solution conductivity, Journal of Pharmaceutical Sciences, 106, 6 (2017), 1634–1643.
IF: 3,075 C: 15
[VII] A. Balogh, B. Farkas, A. Domokos, A. Farkas, B. Démuth, E. Borbás, B. Nagy, G. Marosi, Zs. K. Nagy, Controlled-release solid dispersions of Eudragit® FS and poorly soluble spironolactone prepared by electrospinning and melt extrusion, European Polymer Journal, 95 (2017), 406–417.
IF: 3,741 C: 20
[VIII] B. Farkas, A. Balogh, A. Farkas, A. Domokos, E. Borbás, G. Marosi, Zs. K. Nagy, Medicated straws based on electrospun solid dispersions, Periodica Politechnica Chemical Engineering, 62, 3 (2018), 310–316.
IF: 1,382 C: 7
[IX] T. Casian, A. Farkas, K. Ilyés, B. Démuth, E. Borbás, L. Madarász, Z. Rapi, B. Farkas, A. Balogh, A. Domokos, G. Marosi, I. Tomuta, Zs. K. Nagy, Data fusion strategies for performance improvement of a Process Analytical Technology platform consisting of four instruments: An electrospinning case study, International Journal of Pharmaceutics, 567 (2019), 118473.
IF: 4,845 C: 3
[X] P. Vass, E. Szabó, A. Domokos, E. Hirsch, D. Galata, B. Farkas, B. Démuth, S. K. Anderson, T. Vigh, G. Verreck, G. Marosi, Zs: K. Nagy, Scale‐up of electrospinning technology: Applications in the pharmaceutical industry, WIREs Nanomedicine and Nanobiotechnology, 12, 4 (2019), e1611.
IF: 7,689 C: 6
[XI] L. A. Mészáros, D. L. Galata, L. Madarász, Á. Köte, K. Csorba, Á. Z. Dávid, A. Domokos, E. Szabó, B. Nagy, G. Marosi, A. Farkas, Zs. K. Nagy, Digital UV/VIS imaging: A rapid PAT tool for crushing strength, drug content and particle size distribution determination in tablets, International Journal of Pharmaceutics, 578 (2020), 119174.
IF: 4,845 C: 0
[XII] K. Tacsi, H. Pataki, A. Domokos, I. Csontos, I. Markovits, F. Farkas, Zs. K. Nagy, G. Marosi, Direct processing of a flow reaction mixture using continuous MSMPR crystallizer, Crystal Growth & Design, 20 (2020), 4433–4442.
IF: 4,089 C: 0
[XIII] P. Vass, E. Pantea, A. Domokos, E. Hirsch, J. Domján, Á. Németh, M. Molnár, Cs. Fehér, S. K. Andersen, T. Vigh, G. Verreck, I. Csontos, G. Marosi, Zs. K. Nagy, Electrospun Solid Formulation of Anaerobic Gut Microbiome Bacteria, AAPS PharmSciTech, 21, 214 (2020).
IF: 2.401 C: 0
Hivatkozások listája
[1]: S.L. Lee, T.F. O’Connor, X. Yang, C.N. Cruz, S. Chatterjee, R.D. Madurawe, C.M. V Moore, L.X. Yu, J. Woodcock, Modernizing Pharmaceutical Manufacturing: from Batch to Continuous Production, J. Pharm. Innov. 10 (2015) 191–199. doi:10.1007/s12247-015-9215-8
[2]: S. Mascia, P.L. Heider, H. Zhang, R. Lakerveld, B. Benyahia, P.I. Barton, R.D. Braatz, C.L. Cooney, J.M.B. Evans, T.F. Jamison, K.F. Jensen, A.S. Myerson, B.L. Trout, End-to-end continuous manufacturing of pharmaceuticals: Integrated synthesis, purification, and final dosage formation, Angew. Chemie. 125 (2013) 12585–12589. doi:10.1002/ange.201305429
[3]: A. Adamo, R.L. Beingessner, M. Behnam, J. Chen, T.F. Jamison, K.F. Jensen, J.-C.M. Monbaliu, A.S. Myerson, E.M. Revalor, D.R. Snead, T. Stelzer, N. Weeranoppanant, S.Y. Wong, P. Zhang, On-Demand Continuous-Flow Production of Pharmaceuticals in a Compact Reconfigurable System, Science. 352 (2016) 61–67. doi:10.1126/science.aaf1337
