|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
Richter Gedeon Nyrt, Szerkezetkutatási Osztály
Témavezető: Dr. Szántay Csaba
Növelt hatékonyságú NMR-spektroszkópiai mérések alkalmazása a gyógyszeripari szerkezetkutatásban
A kutatási téma néhány soros bemutatása
A kismolekulás gyógyszeripari szerkezetvizsgálatokkal szemben nemcsak szakmai, de üzleti szempontból is fokozottan erős követelményként jelenik meg a lehető legmagasabb szerkezeti konfidencia, valamint a lehető legteljesebb szerkezeti karakterizálás biztosítása. Ez a két elvárás azonban ellentmond a lehető legrövidebb átfutási idő ugyancsak üzletileg indokolt szigorú követelményének. Ezen ellentmondás feloldásának legnagyobb akadálya az, hogy a szerkezetkutatás egyik legértékesebb eszköztárának, a kétdimenziós (2D) mágneses magrezonancia (NMR) módszereknek az alkalmazása meglehetősen időigényes. A 2D NMR-módszerekben rejlő lehetőségeket rutinszerűn nem lehetett maximálisan kihasználni egészen a közelmúltig, amíg egy igen hasznos mérésgyorsító eljárás, a nem egyenletes mintavételezés (nonuniform sampling, NUS) széles körben elérhetővé nem vált. A NUS gyakorlati alkalmazása azonban közel sem magától értetődő dolog, különösen akkor nem, ha az említett ellentmondó követelményeknek együttesen megfelelni kívánó mérési paraméterek rendszerszintű optimalizálása a cél. Éppen ezért kutatásunk arra irányult, hogy a NUS-t holisztikus szerkezetvizsgálati szemléletet alkalmazva minél hatékonyabban átültessük gyógyszeripari kutatási-fejlesztési és minőségbiztosítási környezetre. Kutatásaink eredményeként a szakirodalomban elsőként mutattuk meg, hogy a NUS egy ismert spektrumfinomszerkezet-egyszerűsítési technikával kombinálva hatékonyan segíti a legnehezebb molekulaszerkezeti kérdések nagy biztonsággal való gyors megválaszolását.
A kutatóhely rövid bemutatása
A Richter Gedeon Nyrt. Szerkezetkutatási Osztályának fő profilja a gyógyszerek kutatása-fejlesztése-gyártása során felmerülő, szerves vegyületek szerkezetével kapcsolatos kérdések megválaszolása. Főállású spektroszkópus kollégáink világszínvonalú NMR-spektrométereken és tömegspektrométereken (MS) végzik méréseiket, munkájuk során a szakirodalomban elérhető legkorszerűbb módszereket honosítják meg és saját innovatív megoldásaikkal [1] hozzájárulnak a magyar gyógyszergyártás sikeréhez.
A kutatás történetének, tágabb kontextusának bemutatása
Az NMR-spektroszkópia gyógyszeriparban betöltött fontos szerepét legkönnyebben minőségbiztosítási szemszögből érthetjük meg. Mivel a gyógyszerek minősége szigorú hatósági szabályozás alatt áll, nem elég csak nagy tisztaságú hatóanyagot (tipikusan >99,5 tömeg%) és pontos összetételű készítményt tételről-tételre következetesen előállítanunk, hanem minden olyan esetleges kísérőkomponensről, nyomszennyezőről számot kell adnunk, amelynek részaránya a hatóanyagban eléri a 0,10%-ot. Ez a folyamat különböző szakterületek mélyreható együttműködését igényli, mint például az analitikai kémia (mennyiségi meghatározás), a preparatív kromatográfia (a nyomszennyező kinyerése a hatóanyag mellől), a nagyműszeres szerkezetkutatás (a dúsított/izolált szennyező molekulaszerkezetének meghatározása), a szintetikus vegyészet (a megfejtett kémiai szerkezetű nyomszennyezőnek megfelelő anyag célzott előállítása nagyobb mennyiségben) és a minőségbiztosítás (jó gyártási gyakorlat - Good Manufacturing Practice, GMP - követelményeinek való megfelelés).
Ebben az együttműködésben a szerkezetkutatók munkájának is nagy tétje van, mert egy gyógyszergyártáshoz köthető szerkezetvizsgálati hiba súlyos pénzügyi és reputációs veszteséggel járhat. Egy nyomszennyező-vizsgálati projektben egy rosszul meghatározott szerkezet miatt többek között nagy szintetikus kémiai erőforrás veszhet kárba (egy kisebb kutatócsoport néhány hónapos munkája). Más kutatási témákban, mint például egy eredeti gyógyszer kifejlesztésekor a tévesen megállapított szerkezet hibásan alakítja a szerkezet–hatás összefüggés modelleket és eltérítheti a helyes fejlesztési iránytól az adott projektet. Mindezen okok miatt a hatékony, pontos és gyors szerkezetmeghatározás elengedhetetlen egy gyógyszergyár életében.
A kutatás célja, a megválaszolandó kérdések.
Kutatásunk céljának megragadásához tekintsük át egy gyógyszeripari NMR-spektroszkópus munkakörnyezetét! Az ipari környezet sajátsága (az egyetemi vagy kutatóintézeti környezethez képest), hogy szoros határidőket tartunk, ami folyamatosan dilemma elé állítja a szerkezetkutatót: bánjon gazdaságosan a műszeres erőforrásokkal és csak alapméréseket végezzen el, hogy áttérhessen a következő mintára (évente több ezer minta!), vagy gyűjtsön be több kísérleti adatot, hogy jobban tudja bizonyítani a feltételezett molekulaszerkezeteket.
További stressztényezőt jelent, hogy a műszeres mérési adatok értelmezése korántsem egyértelmű. Például, ha egy hidrogénatom és egy szénatom között kapcsolatot mérünk HMBC módszerrel (lásd később), nem mutatják a mérések, hogy ezek az atomok kettő vagy három kötésre vannak egymástól. A döntéshez kiegészítő mérési adatok (hosszabb mérések) szükségesek, különben a kémiai kontextus (kiindulási anyagok, reagensek, oldószerek) alapján kell valószínűsíteni, hogy mi lehet egy spektrumcsúcs jelentése. Amennyiben túlzottan támaszkodunk a kémiai kontextusbeli ismeretekre, beleeshetünk abba a csapdába (főleg az időpresszió okán), hogy túl sok mérési adat jelentését vesszük egyértelműnek, és visszaigazolunk egy olyan szerkezetet, ami a kémiai racionalitás alapján helyesnek tűnik, a valóságban azonban hibás.[2]
Kutatásom célkitűzése egy ismert NMR-mérésgyorsító technika, a nem egyenletes mintavételezés (nonuniform sampling, NUS) átültetése a gyógyszeripari alkalmazási gyakorlatba. Kérdéseim arra irányultak, hogy mennyire oldható fel a szerkezetkutató fent bemutatott dilemmája, illetve milyen esetekben elengedhetetlen a NUS használata a problémamegoldáshoz.
Módszerek
A gyógyszerhatóanyagok és rokon vegyületeinek szerkezetmeghatározása során tipikusan hatféle, egymást kiegészítő NMR-spektroszkópiai adatsort gyűjtünk be (1. ábra). Ezek az 1H NMR-spektroszkópia, a 13C NMR-spektroszkópia, valamint négyféle atommag-atommag kapcsolatot vizsgáló kétdimenziós NMR-technika: 1H-1H kapcsolatok néhány (általában 3) kötésen át (COSY), 1H-1H kapcsolatok térbeli közelség alapján (NOESY), közvetlen 1H-13C kapcsolatok (HSQC), távolható 1H-13C kapcsolatok (általában 2-3 kötés, HMBC). Egy egyszerű példán keresztül szemlélteti a főbb szerkezetvizsgáló NMR-méréseket az 1. ábra.
Fontos kiemelni, hogy az NMR-spektroszkópiában sok szerkezeti információra (például oxigénatomok) csak közvetetten, a kémiaieltolódás-összefüggésekből tudunk következtetni. Ezért mindig együttműködünk egy tömegspektroszkópussal, aki a molekulatömegre és az elemi összetételre vonatkozóan végez méréseket.
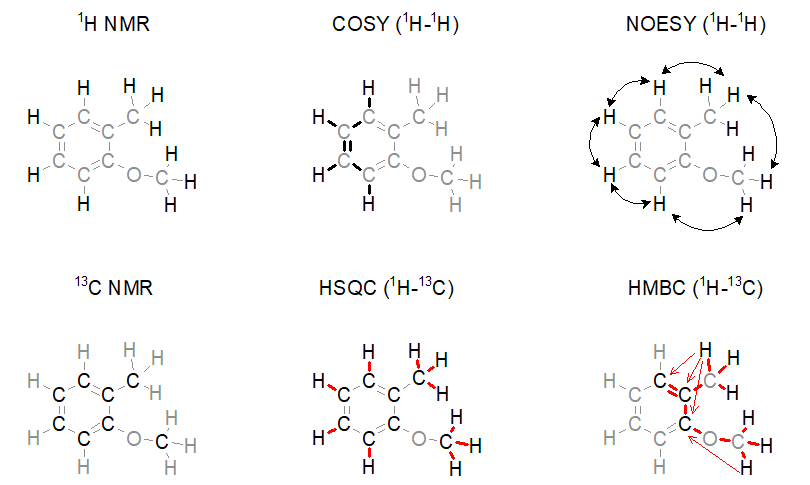
1. ábra: Gyógyszermolekulák kémiai szerkezetének vizsgálata során használt legfontosabb NMR-spektroszkópiai módszerek
Az NMR-spektrumok értelmezhetősége leginkább két tényezőn múlik. Egyrészt, kevés anyag (1–5 mg) esetén a mérések alacsony jel–zaj viszonya szab határt az atomokhoz tartozó jelek detektálásának, aminek például 13C NMR-spektroszkópiában van jelentősége (2a. ábra), ugyanis a 12C mágnesesen inaktív, a mérhető 13C-izotóp viszont csak 1%-ban fordul elő. Másrészt, sok spektrumcsúcs esetén azok átfedése okozhat jelértelmezési problémákat. Az 1H NMR-spektrumok felbontása nagyobb mágneses tér alkalmazásával jelentősen javítható. Ezzel szemben a kétdimenziós (2D) NMR-spektroszkópiában hagyományosan a felbontás csak további adatpontok (akár több ezer) felvételével javítható (2b. ábra), függetlenül az anyagmennyiségtől és a hardver képességeitől. Ezért lassúak a 2D NMR-mérések (adatpontoként több másodperc), bonyolult szerkezetek esetében órákig tarthat egy spektrumfelvétel, de egyszerű minták esetében is 1–2 órát igényel a négyféle (COSY, NOESY, HSQC, HMBC) mérés.
A NUS-módszertan lényege, hogy az NMR-jelek pozíciójának (ami egy frekvencia jellegű mennyiség) megállapításához nincs szükség minden egyes (intenzitás az idő függvényében) adatpontra. Ez ahhoz a szituációhoz hasonlít, mint amikor egy szinuszhullám frekvenciáját szeretnénk meghatározni. Ha tudjuk, hogy szinuszos a jel és tudjuk, hogy milyen tartományban mozoghat a frekvenciája, akkor a pontos frekvencia megállapítása néhány adatpontból megoldható. Ha több frekvencia kombinációjából tevődik össze a jel (több spektrumcsúcsunk van), akkor sem szükséges a teljes jelet mintavételezni, csak a várt frekvenciaösszetevők számának néhányszorosát.[3] Ez azt jelenti, hogy nagyfelbontású 2D NMR-spektrumot vehetünk fel úgy is, hogy a mérés közben az ezernyi kijelölt adatpont egy részét (akár több mint 90%-át) véletlenszerűen kihagyjuk és egy szoftveres algoritmusra bízzuk a hiányzó pontok kipótolását (2c. ábra). A műszergyártók az erre alkalmas megoldásokat az elmúlt évtizedben tették széles körben hozzáférhetővé (korábban a módszert a szerkezeti biológiai NMR-mérésekben alkalmazták).

2. ábra: a) Pillanatképek egy híg mintához tartozó 13C NMR-spektrumról, NS = ismétlések száma, csillag: spektrumcsúcsok helye; b) Az anyagról hagyományos mintavételezéssel készült HSQC-spektrum, n = adatpontok száma (ld. a spektrumtól balra lévő sáv); c) Ugyanannak az anyagnak a NUS HSQC-spektruma, n = kiválasztott adatpontok száma (eloszlásukat ld. a spektrumtól balra lévő sáv)
Kutatásom során optimalizáltam azt, hogy különböző gyógyszeripari feladattípusokban mennyi adatpont mérését tervezzük be és azok közül maximálisan mennyit lehet kihagyni.
Megfigyeltem, hogy az extrém nagy felbontású spektrumokban a csúcsok finomszerkezete korlátozza a NUS alkalmazhatóságát. A probléma elkerülésére elsőként kombináltam a NUS-t egy ismert spektrumcsúcs-egyszerűsítő [4] technikával.
Eddigi eredmények
Egy alkaloidkémiai témájú együttműködési projektben a vinblasztinnal rokon vegyületek szintézisekor partnereink (BME Alkaloidkémiai Kutatócsoport) egy váratlan és furcsa mellékterméket, egy vindolin trimert állítottak elő. Szerkezetkutatási szempontból ennek a mellékterméknek a megfejtése azért volt kiemelten nehéz, mert a három vindolin alegységhez tartozó NMR-jelek sok esetben átfedtek egymással, tehát rengeteg bizonytalanul értelmezhető információt tartalmaztak a hagyományos metodikával felvett NMR-spektrumok. Munkám során egy csúcstechnológiás, hűtött mérőfejjel ellátott 800 MHz-es NMR-spektrométer segítségével, a NUS felbontásnövelő képességének felhasználásával határoztam meg a 188 atomot tartalmazó vegyület (elemi összetétel: C74H90N6O18) struktúráját. A Módszerek fejezetben bemutatott HSQC- és HMBC-méréseket úgy végeztem, hogy 8192 adatpontból csak 256-ot (97%-os kihagyás), illetve 512-t (94%-os kihagyás) mértem meg, ezáltal 6 órás HSQC-mérést 11 percre, a 12 órás HMBC-mérést 47 percre csökkentettem. A kapott spektrumokon lévő mintegy ezer információból (egy részletét lásd 3. ábra) levezettem a keletkező melléktermék szerkezetét.[S2]
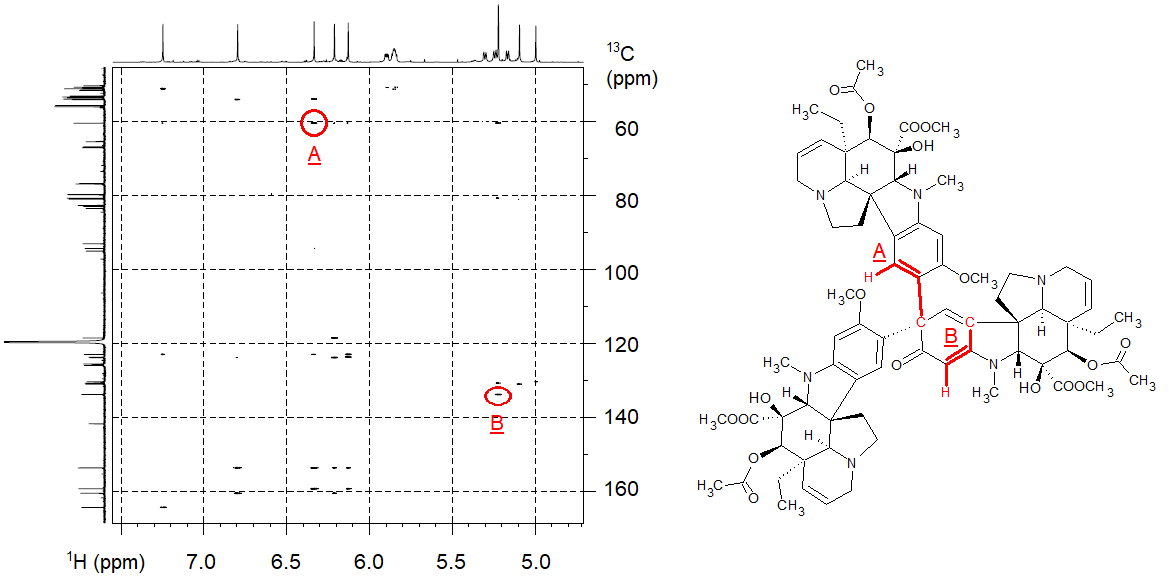
3. ábra: NUS módszerrel felvett nagyfelbontású HMBC-spektrum (a tengelyeken 1H és 13C NMR kémiai eltolódások szerepelnek), példaként két spektrumcsúcs értelmezése látható a szerkezeti képleten
A gyógyszeripari szerkezetvizsgálatok nagy részét kitevő, a kémiai szintézist támogató feladatok esetén tapasztalati úton felállítottam egy mérési protokollt, ami a NUS lehetőségeit maximálisan kihasználja. Töményebb minták esetében a hat spektrum (1. ábra) 21 perc alatt felvehető a korábban jellemző 1–2 óra helyett.[S3] A híg minták esetére írtam egy prototípus programot házon belüli használatra, amely automatizálja a mérési paraméterek átszámítását, és csekély felhasználói beavatkozás mellett elindítja a méréseket. Ezzel sikerült biztosítani azt, hogy nagy biztonsággal határozzunk meg szerkezeteket rövid határidővel. A kutató már csak kevés esetben kényszerül dönteni a biztosabb szerkezetmeghatározás és a gyorsabb átfutási idő között.
Munkám egyik legfőbb újdonsága, hogy kombináltam a NUS-t a constant time-ként (CT) ismert csúcsfinomszerkezetet részlegesen egyszerűsítő módszerrel, aminek köszönhetően gyorsan tudtam biztos szerkezeti információkat tudtam kinyerni a legbonyolultabb rendszerekről, mint például egy propargil-éter funkciós csoportot négyszeresen tartalmazó vegyületről. A háromszoros kötésekben részt vevő összesen nyolc szénatom egy nagyon szűk spektrumtartományban (egy 200 ppm-es skála 1 ppm-es részlete) zsúfolódott össze. A HMBC-jeleket még a NUS-sal felbontott spektrummal (4a. ábra) sem tudtuk a megfelelő atomokhoz hozzárendelni, mert a jelek finomszerkezete akadályozta a szoftveres algoritmust a spektrumrekonstrukciós műveletben. Ezért a szerkezetet először nem sikerült igazolni. Ezzel szemben az általam javasolt mérési módszertannal a korábbinál sokkal tisztább spektrumot nyertünk (4b. ábra), amelynek segítségével bizonyítottuk a négy propargilcsoportban (4. ábra, P1…P4) az atomok megfelelő összekapcsolódását.[S3]
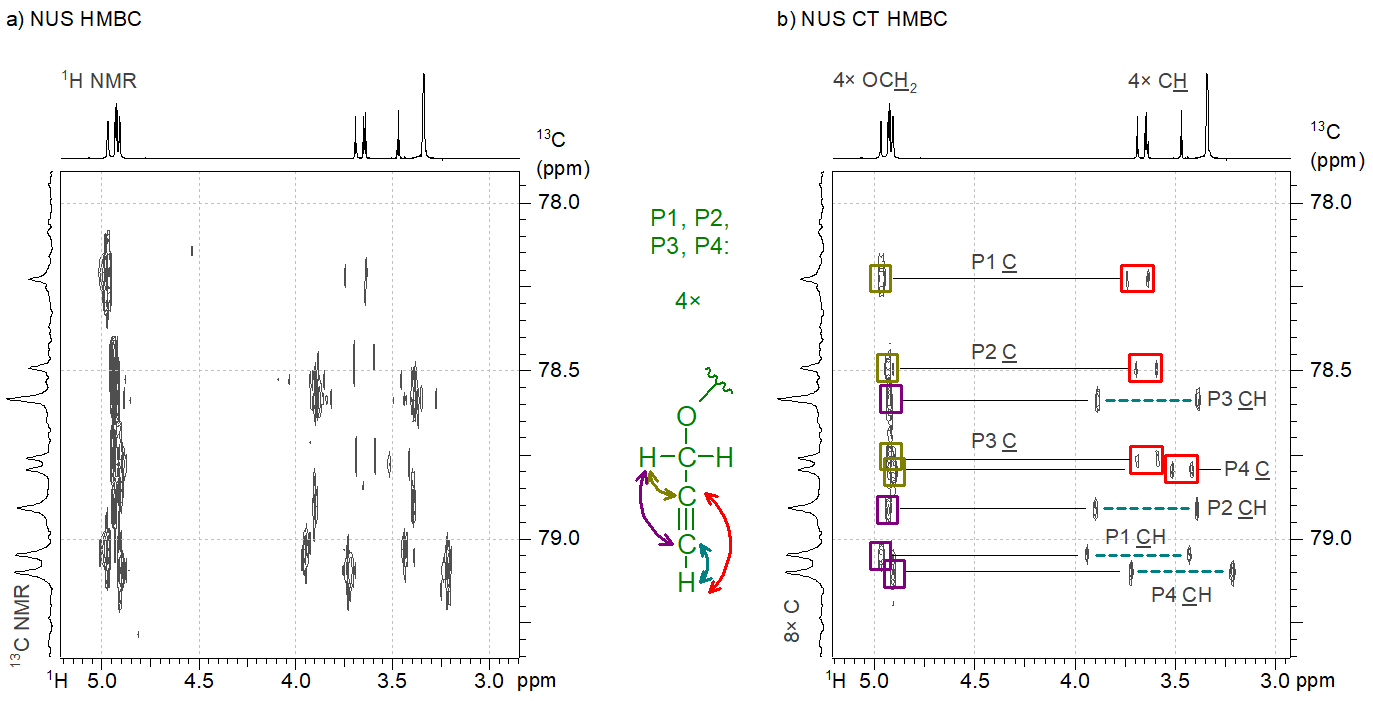
4. ábra: a) Egy tetrakisz(propargil-éter) típusú vegyület NUS HMBC-spektruma és b) ugyanennek a vegyületnek a constant time (CT) technikával felvett NUS HMBC-spektruma
Új megközelítésünket sikeresen alkalmaztuk egy gyógyszergyártási alapanyag 0,14%-os mennyiségben lévő nyomszennyezőjének szerkezetfelderítésében is. Az alapanyag CT NUS HMBC- és NUS HSQC-spektrumából megállapítottuk, hogy egy konstitúciós izomer volt a szennyező (5. ábra). Hagyományos spektrumfelvételi technikával a keresett szennyező jeleit nem találtuk volna meg. A módszer gyógyszeripari alkalmazására további példákat írtunk le.[S3]
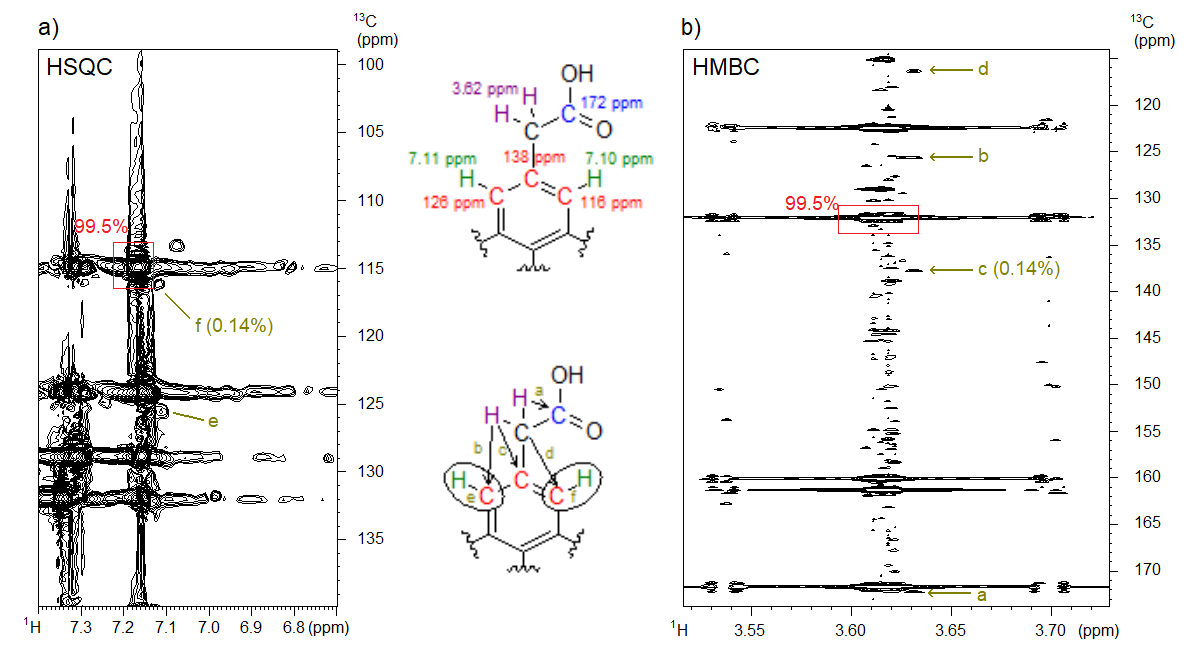
5. ábra: a) A keresett 0,14%-os nyomszennyezőt tartalmazó minta HSQC- és b) HMBC-spektruma 800 MHz-es NMR-spektrométeren. A felső szerkezeti képleten néhány atomhoz tartozó kémiai eltolódások szerepelnek (jelpozíciónak feleltethetők meg a spektrumokban), az alsó képleten a spektrumokban megjelölt hat csúcs (a–f) értelmezése látható.
Várható impakt, további kutatás
Eredményeink tudományos szakirodalomban való publikációját követően továbbfejlesztettük az NMR-mérőszoftverhez írt programmodulunkat, amely automatizálja az optimális NUS mérési beállítások kiszámítását és a mérések elindítását. A programunk már több száz munkaórát megtakarított számunkra. A továbbiakban is szorosan követjük a legújabb fejleményeket a szakirodalomban, hogy a legmodernebb és leghatékonyabb NMR-mérési eljárásokat honosítsuk meg a Richterben. Új ötletünk, amely a constant time technika és a NUS kombinációján alapul, más szerkezetvizsgáló laboratóriumok számára is megkönnyítheti a legbonyolultabb szerkezetek meghatározását. Munkánkra eddig egy független hivatkozás érkezett.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája.
[S1] Szigetvári Á., Szántay Cs. Szerkezetkutatás NMR-spektroszkópiával a gyógyszeriparban: hatékonyságnövelés nem egyenletes mintavételezés segítségével. Magy. Kém. Foly. 2020, 126, 135–146.
[S2] Á. Szigetvári, A. Keglevich, P. Keglevich, M. Dékány, L. Hazai, C. Szántay, Jr. A mainly NMR-based structure elucidation of a surprising vindoline trimer with the aid of non-uniform sampled 1H-13C HSQC and HMBC spectra. Struct. Chem. 2021, 30, 795–804. (IF: 1,887)
[S3] Á. Szigetvári, C. Szántay, Jr. On the utility of non-uniformly sampled two-dimensional NMR spectra in the pharmaceutical industry. Magn. Reson. Chem. 2021, 59, 264–286. (IF: 2,447)
[S4] Szigetvári Á., Keglevich A., Pápai R., Dékány M., Béni Z., Keglevich P., Hazai L., Szántay Cs. A vinka alkaloidok szerkezetkutatása az NMR spektroszkópia szemszögéből - két érdekes esettanulmány. Alkaloid- és Flavonoidkémiai Munkabizottság, Mátrafüred, 2016.
[S5] Szigetvári Á., Keglevich A., Pápai R., Dékány M., Keglevich P., Hazai L., Béni Z., Szántay Cs. A vinka alkaloidok szerkezetkutatása az NMR spektroszkópia szemszögéből - két érdekes esettanulmány. Fiatal Analitikusok Előadóülése, Budapest, 2016.
[S6] Szigetvári Á. A maradékos osztás (spectral aliasing) alkalmazása egy meglepő vindolin trimer szerkezetmeghatározására. A Magyar NMR Munkabizottság ülése, Debrecen, 2016.
[S7] Á. Szigetvári, A. Keglevich, M. Dékány, P. Keglevich, Z. Béni, L. Hazai, C. Szántay, Jr. NMR-based structure elucidation of a surprising trimeric vindoline product with the aid of heteronuclear spectral aliasing methods. Magnetic Moments in Central Europe, Budapest, 2017.
[S8] Szigetvári Á. Az NMR spektroszkópia alkalmazásának sokszínűsége a gyógyszeripari kutatásban. I. Fiatal Kémikusok Fóruma (FKF) Szimpózium, Debrecen, 2019.
[S9] Szigetvári Á., Szántay Cs. Szerkezetkutatás NMR-spektroszkópiával a gyógyszeriparban: hatékonyságnövelés nemegyenletes mintavételezés segítségével. Fiatal Analitikusok Előadóülése, online, 2020.
[S10] Á. Szigetvári, C. Szántay, Jr. On the utility of nonuniformly sampled two-dimensional NMR spectra in the pharmaceutical industry. Magnetic Moments in Central Europe, Primošten, Horvátország, 2022.
Linkgyűjtemény.
Szerkezetvizsgálat, szerkezetkutatás (videó)
Kétdimenziós NMR-spektroszkópia (2D NMR)
Nem egyenletes mintavételezés (hivatkozás [S1] folyóiratcikkre)
NMR-spektroszkópia, NMR-spektrométer
Tömegspektrometria, tömegspektrométer (MS)
Hatósági szabályozás (gyógyszerek)
Good Manufacturing Practice (GMP)
Szerkezetvizsgálati hiba következménye
Csapda, mentális csapda (a tudományban)
Kémiaieltolódás-összefüggések (1H NMR, 13C NMR)
Szerkezeti biológiai NMR-mérések
BME Alkaloidkémiai Kutatócsoport
800 MHz-es NMR-spektrométer (videórészlet)
Hivatkozások listája.
[1] Z. Szeleczky, Z. Szakács, É. Bozó, F. Baska, K. Vukics, S. Lévai, K. Temesvári, E. Vass, Z. Béni, B. Krámos, I. Magdó, C. Szántay Jr., J. Kóti, K. Domány-Kovács, I. Greiner, I. Bata. Synthesis and Characterization of New V1A Antagonist Compounds: The Separation of Four Atropisomeric Stereoisomers. J. Med. Chem. 2021, 64, 10445–10468.
[2] C. Szantay, Jr. (szerk.) Anthropic Awareness – The Human Aspects of Scientific Thinking in NMR Spectroscopy and Mass Spectrometry. Elsevier, 2015.
[3] A. Shchukina, P. Kasprzak, R. Dass, M. Nowakowski, K. Kazimierczuk. Pitfalls in compressed sensing reconstruction and how to avoid them. J. Biomol. NMR, 2017, 68, 79–98.
[4] K. Furihata, H. Seto. Constant time HMBC (CT-HMBC), a new HMBC technique useful for improving separation of cross peaks. Tetrahedron Lett. 1998, 39, 7337–7340.
