|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
ELKH Természettudományi Kutatóközpont
Témavezető: Dr. Turiák Lilla
Prosztatarák diagnosztikáját elősegítő új molekuláris markerek kimutatása
A kutatási téma néhány soros bemutatása
A proteoglikánok egy fehérjevázból és hozzájuk kapcsolódó lineáris poliszacharidokból álló makromolekulák, amelyek részt vesznek a sejtek közötti tér felépítésében és az intercelluláris kommunikáció koordinálásában. Ezáltal kiemelt szereppel rendelkeznek a rákos megbetegedések kialakulásában és az áttétek képződésében. Kutatómunkám során arra keresem a válaszokat, hogy ezen vegyületcsaládban kimutathatók-e olyan biokémiai változások, melyek elősegíthetik a prosztatarákos elváltozások pontosabb kockázatbecslését, ezáltal segítve a terápiás döntések meghozatalát. Vizsgálataimhoz saját fejlesztésű szöveti minta-előkészítési és HPLC-MS mérési módszereket alkalmazok, ezzel lehetővé téve kis mennyiségű szöveti biopsziák lokalizált vizsgálatát.
A kutatóhely rövid bemutatása
Kutatómunkámat a Természettudományi Kutatóközpont MS Proteomika Kutatócsoportjában végzem Dr. Turiák Lilla témavezetése alatt. Kutatócsoportunk munkájának fókuszában a fehérjék és hozzájuk kapcsolódó poszt-transzlációs módosulások (szénhidrátok esetén ún. glikoziláció) minőségi és mennyiségi vizsgálata áll különböző megbetegedések során. A kutatásokhoz több hazai és nemzetközi patológiai intézet is hozzájárul, az elemzéseket a legkorszerűbb műszeres analitikai és adatértékelési módszerekkel végezzük.
A kutatás történetének, tágabb kontextusának bemutatása
A prosztatarák a tumoros elváltozások 14,1 %-át teszi ki férfiak körében, ezzel az egyik leggyakoribb rákos megbetegedés [H1]. Halálozási rátáját tekintve visszafogottnak tekinthető, amihez nagyban hozzájárult a prosztata specifikus antigén (PSA) vérszintjének rutinszerű szűrése az 50 év feletti populációban. Az elváltozások súlyosságának becsléséhez a PSA-szinten kívül a klinikai tumoros stádiumot és a sejtek differenciáltságára jellemző ún. Gleason-pontszámot együttesen alkalmazzák. A jelenlegi kockázatbecslések azonban számos esetben szükségtelen beavatkozásokhoz (elsősorban teljes prosztatarezekcióhoz) vezetnek, amelynek kellemetlen mellékhatásai eltérő terápiás útvonalak megválasztásával elkerülhetők lennének. A kifinomultabb kockázatbecslési csoportok létrehozásához azonban új markerek azonosítása szükséges.
Erre nyújt
lehetőséget a proteoglikánok (PG-k) vegyületcsaládjának szöveti vizsgálata,
melyeket korábban számos tumoros elváltozás kialakulásával kapcsolatba hoztak
[H2].
A
proteoglikánok
olyan makromolekulák, amelyekben kitüntetett vázfehérjékhez ismétlődő
diszacharidokból felépülő szulfatált lineáris poliszacharid láncok (glükózaminoglikánok,
GAG-ok) kapcsolódnak. A PG-k részt vesznek a sejtek közötti tér felépítésében
és a jelátviteli folyamatok koordinálásában. Ezáltal a tumorok kifejlődése és
az áttétképzés során is jelentős szerepük van. Ezen funkciók betöltéséhez
nagyban hozzájárul a kapcsolódó GAG-láncok mennyisége, lánchossza, valamint
szulfatáltságuk mértéke és pozíciója.
A GAG-okat az ismétlődő diszacharid-egységek fajtája alapján négy osztályba soroljuk: i) hialuronán, ii) keratán-szulfát, iii) kondroitin-szulfát/dermatán-szulfát (CS/DS), iv) heparin/heparán-szulfát (Hep/HS). Munkám során a CS és HS osztályokkal foglalkozom.
A tömegspektrometriával kapcsolt technikák (különösen a kapilláris ultranagy hatékonyságú folyadékkromatográfia - tandem tömegspektrometria, UHPLC-MS/MS) kiválóan alkalmasak különböző komplex biológiai mátrixszal rendelkező minták összetételének meghatározására és mennyiségi analízisére. A módszer alkalmazása során a komponensek meghatározott fizikai kémiai paraméterek (pl. hidrofób jelleg) alapján elválasztásra kerülnek, így időben elkülönülve érkeznek a kapcsolt tömegspektrométerbe. Az MS-sel meghatározható a molekulák tömeg/töltés (m/z) -értéke és -intenzitása, ami lehetőséget nyújt párhuzamos minőségi és mennyiségi analízisre. A GAG-ok kis mennyiségű szövetmintákból történő vizsgálatához azonban a minták előkészítése és a mérési módszerek tekintetében egyaránt speciális módszerek fejlesztése és alkalmazása szükséges.
A kutatás célja, a megválaszolandó kérdések.
Kutatómunkám első célja szöveti glükózaminoglikánok vizsgálatára alkalmas minta-előkészítési és mérési módszerek fejlesztése volt. Szükségesnek bizonyult az emésztési és extrakciós folyamatok optimálása, újfajta szilárd fázisú extrakciós módszerek és kis mennyiségű szövetmetszetek GAG-tartalmának megbízható vizsgálatára alkalmas HPLC-MS-módszerek fejlesztése.
A módszerek fejlesztése után célom volt különböző súlyosságú prosztatarákos (PCa) és jóindulatú prosztata megnagyobbodásos (BPH) páciensek szöveti biopsziáinak vizsgálata. Ezen vizsgálatok kettős célt szolgáltak: i) olyan molekuláris folyamatok kimutatása, amelyek a jelenlegi kockázati besorolásokkal összhangban vannak és potenciális terápiás célpontok azonosítását teszik lehetővé, ii) a jelenleginél részletesebb kockázatbecslési módszerek kidolgozására alkalmas (független) markerek azonosítása a túlkezelés csökkentésére. A mérési adatok értékelése során így célom többváltozós modellek építése új glükózaminoglikán-alapú markerek felfedezésére a prosztatarákos elváltozások kockázatbecslésére.
Módszerek
Mintagyűjtés
A vizsgálati minták és a betegadatok gyűjtése az Esseni Kórház (Németország) Urológiai Klinikáján történt, Dr. Szarvas Tibor vezetésével. A vizsgált kohort az esetszámokat, a klinikai paramétereket, az életkort, a túlélés hosszát és a tumoros sejtarányt tekintve egyaránt kiegyensúlyozott volt. A vizsgálatokhoz jóindulatú prosztatamegnagyobbodásos (n=14), alacsony (n=20), közepes (n=20) és magas (n=17) kockázatú prosztatarákos páciensek formalin-fixált, paraffinba ágyazott (FFPE) szövetmintáit vizsgáltam. Az FFPE-minták vizsgálata a szövetek tartóssága miatt lehetővé teszi hosszú követési/túlélési idővel rendelkező betegségek vizsgálatát, ez prosztatarák esetén akár 30 év is lehet.
Szövetek előkészítése
A vizsgálatok megkezdésekor első lépésként a szövetekről eltávolítottam a paraffint egy irodalomban elterjedten használt xilolos-etanolos mosási folyamattal. Ezután az ún. antigén-előhívás során a metszeteket 30 percen át forralva nátrium-citrát vizes oldatában, felszakítottam a formalin által létrehozott keresztkötéseket a szöveti makromolekulák között, annak érdekében, hogy az enzimatikus degradiáció (emésztés) során az enzimek megfelelően hozzáférhessenek a kiválasztott molekulákhoz.
GAG-láncok enzimatikus emésztése
Az emésztést a CS-láncok vizsgálata során kondroitináz-ABC enzimoldattal (pH=7,6), míg a HS-láncok vizsgálatához Heparin-liáz I-II-III enzimkeverékkel (pH=7,6) végeztem. Az enzimoldatok szövetfelületre történő adagolását ciklikusan végeztem (a 24, illetve 48 órás emésztési időperiódust 5 egyenlő részre osztva), így biztosítva a folyamatos enzimaktivitást és a szöveti GAG-ok teljes konverzióját [S1, S2]. Az emésztés során keletkező diszacharidokat (a CS- és HS-láncok ismétlődő szulfatált diszacharid egységeit, 1. ábra) ezután 1% ammóniaoldat ötciklusos ismételt pipettázásával kivontam a szövetfelületről, majd az oldatokat bepároltam. Ehhez saját fejlesztésű módszert alkalmaztam, mellyel biztosítható a lehető legkisebb veszteség a szulfatációs mintázat torzítatlansága mellett [S8].

1. ábra Kondroitin-szulfát és heparán-szulfát láncok enzimatikus emésztésének folyamata és a keletkező diszacharid ismétlődő egységek. Az egyes diszacharidok mellett az ún. Lawrence-kódos jelölés látható
Szilárd fázisú extrakciós tisztítás
Következő lépésként az emésztési keveréket szilárd fázisú extrakció (SPE) alkalmazásával megtisztítottam a pufferkomponensektől és enzimektől. Az SPE-tisztítás során a mintát egy szilárd állófázisra visszük fel oldat formájában, amelyen a célkomponensek megkötődnek, míg a vizsgálni nem kívánt molekulák a mosási lépés során eltávolíthatók. Ezt követően az elúciós lépésben leoldottam a GAG-diszacharidokat az állófázisról. A tisztításhoz kifejlesztettünk egy módszert, mely környezetbarát saját töltésű vatta állófázis és kereskedelmi forgalomban kapható grafitalapú állófázis kombinációjával lehetővé teszi a GAG-diszacharidok torzítatlan tisztítását (publikáció előkészítés alatt).
nanoUHPLC-MS/MS mérések
A vizsgálatokhoz saját készítésű, kombinált mechanizmusú hidrofil-interakciós kromatográfián és gyenge anioncserén (HILIC-WAX) alapuló kolonnát alkalmazva egy-egy innovatív sógradiens módszert fejlesztettem HS és CS diszacharidok vizsgálatára [S4, S5]. A módszer alkalmazásával a korábbi irodalmi eredményekhez képest akár tízszer alacsonyabb kimutatási határok mellett vizsgálhatók a GAG-diszacharidok, ez az érzékenységnövekedés elengedhetetlen volt a kis mennyiségű szöveti biopsziák robusztus vizsgálatához. A munkafolyamat összefoglalása a 2. ábrán látható.
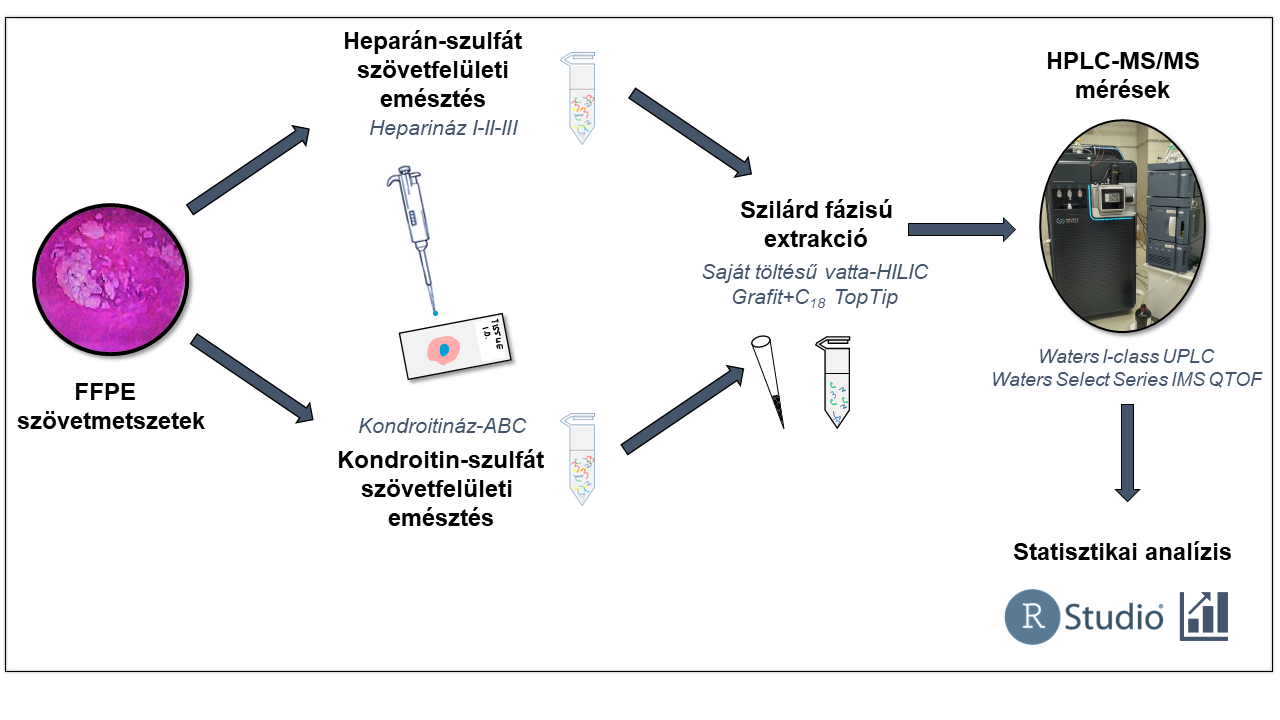
2. ábra A prosztatarákos szövetminták előkészítésének, mérésének és értékelésének vázlatos munkafolyamata
Adatok értékelése
A mérési eredmények értékelését általános statisztikai csoport-összehasonlításokat követően Kaplan-Meier (KM) -analízissel végeztük. A KM-analízis alapján szignifikáns túlélésbeli eltérést mutató markereket ezután multivariancia-analízisnek vetettük alá, hogy meghatározzuk, hogy kimutató-e függetlenség a jelenleg kockázatbecslésre alkalmazott klinikai paraméterektől (klinikai tumoros stádium, PSA-vérszint, Gleason-pontszám).
Eddigi eredmények
Összefüggések jelenlegi kockázaticsoport-besorolásokkal
A CS-láncok összmennyiségében 1,6–2,0-szoros szignifikáns (p<0,05) növekedés tapasztalható a prosztatarákos szövetekben a BPH-hoz képest. Statisztikailag szignifikáns eltérések nem mutathatók ki az egyes kockázati csoportok között, azonban az átlag és medián értékek kismértékű növekedése tapasztalható a PCa progressziójával (3. ábra). A HS-láncok összmennyiségében szintén kismértékű (1,3–1,4-szeres) növekedés tapasztalható a PCa-szövetekben a BPH-hoz képest (3. ábra).
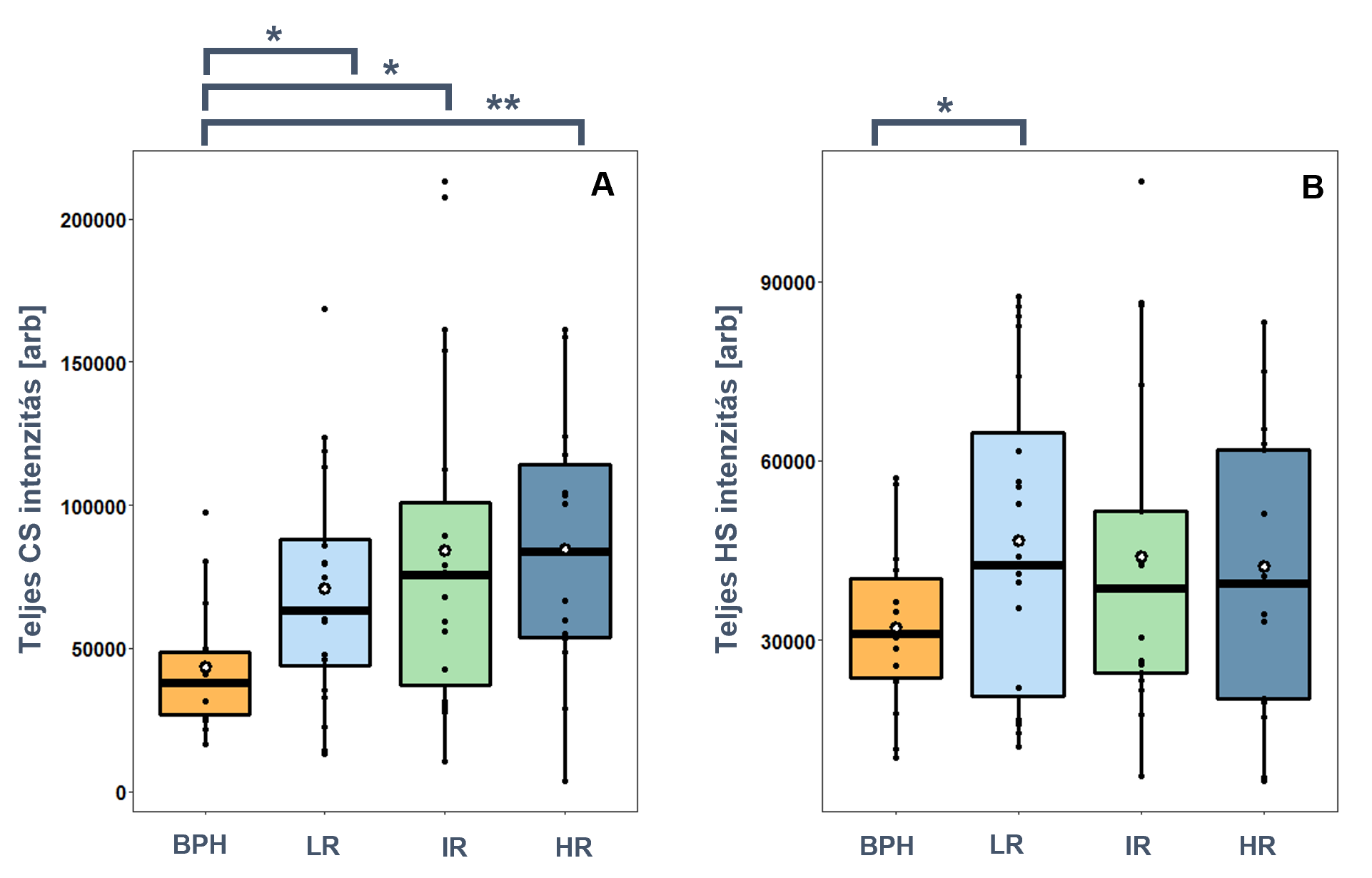
3. ábra
BPH és alacsony (LR), közepes (IR), magas (HR) kockázati besorolású
prosztatarákos minták glükózaminoglikán összmennyisége. A: Kondroitin-szulfát,
B: Heparán-szulfát.
(*:p<0,05, **:p<0,01)
Az egyes diszacharidok relatív mennyiségét összehasonlítva megállapítottam, hogy a legjelentősebb eltérések a monoszulfatált CS-diszacharidok relatív intenzitásában voltak kimutathatók (4/A ábra). A D0a4 diszacharid relatív intenzitása szignifikánsan alacsonyabb PCa-ban, mint BPH-ban, és a PCa progressziójával egy további csökkenő tendencia figyelhető meg. A D0a6 diszacharid ellentétes tendenciát mutatott: az alacsony kockázati csoportban kismértékű emelkedés figyelhető meg BPH-hoz képest, azonban nagy mértékű relatív intenzitásnövekedés volt kimutató a PCa progressziójával (4/B ábra).

4. ábra BPH és alacsony (LR), közepes (IR), magas (HR) kockázati besorolású prosztatarákos minták monoszulfatált CS-diszacharidok relatív intenzitása a teljes CS-mennyiséghez viszonyítva. A: D0a4, B: D0a6. (*:p<0,05, **:p<0,01, ***:p<0,001)
Eredményeink alátámasztják, hogy a CS-mennyiség növekedése a 6-O-szulfatáció arányának párhuzamos növekedésével összefüggésbe hozható a szöveti átrendeződéssel és a tumorprogresszióval [H3]. A kondroitin-6-szulfát (C-6-S) gátolja a gyulladáskeltő molekulák felszabadulását a makrofágokból, gátolja a gyulladásos mediátorok egy jelentős részét és az NF-κB-aktivációt, így a növekvő mennyiségű C-6-S fenntartja a sejtek M2 polarizációját, ami elősegíti a tumorok életben maradását [H4].
A HS-láncok szulfatációja esetén kisebb és kevésbé szignifikáns változások voltak kimutathatók. Ezek közül legjelentősebbnek tekinthető a HS átlagos szulfatációjának kismértékű csökkenése, és az N-szulfatáció előtérbe kerülése az O-szulfatációval szemben a prosztatarák kockázati csoportjának növekedésével.
Túlélési valószínűség – Kaplan-Meier-analízis
A prosztatarákos betegek túlélési valószínűsége és a GAG-motívumok szintjei közti összefüggés vizsgálatához Kaplan-Meier (KM) -túlélési görbéket készítettem. A KM-ábrák megmutatják, hogy a vizsgált populációban a mintavétel időpontját követően milyen időpontban történt prosztatarákhoz köthető halálozás. A vizsgálat idejében életben maradt vagy nem prosztatarákhoz köthető oknál fogva elhunyt betegek cenzorált adatokként szerepelnek.
A KM-analízis során megállapítottam, hogy szignifikánsan különböző túlélésű csoportok (logrank P < 0,05) alakíthatók ki a D0a10 CS diszacharid relatív intenzitása, valamint a teljes HS-tartalom, a D2S0/D0S6 és a D2S6 HS diszacharidok relatív intenzitása alapján (5. ábra). A túlélés tekintetében szignifikáns eltérést mutató GAG-motívumok esetén nem volt szignifikáns eltérés a jelenleg alkalmazott kockázati csoportok között. Kismértékű csökkenő tendencia tapasztalható a kockázati csoport emelkedésével, amely összhangban van a KM-analízis adataival, miszerint a legtöbb esetben az adott GAG-motívum alacsonyabb mennyisége rövidebb túléléssel párosul.
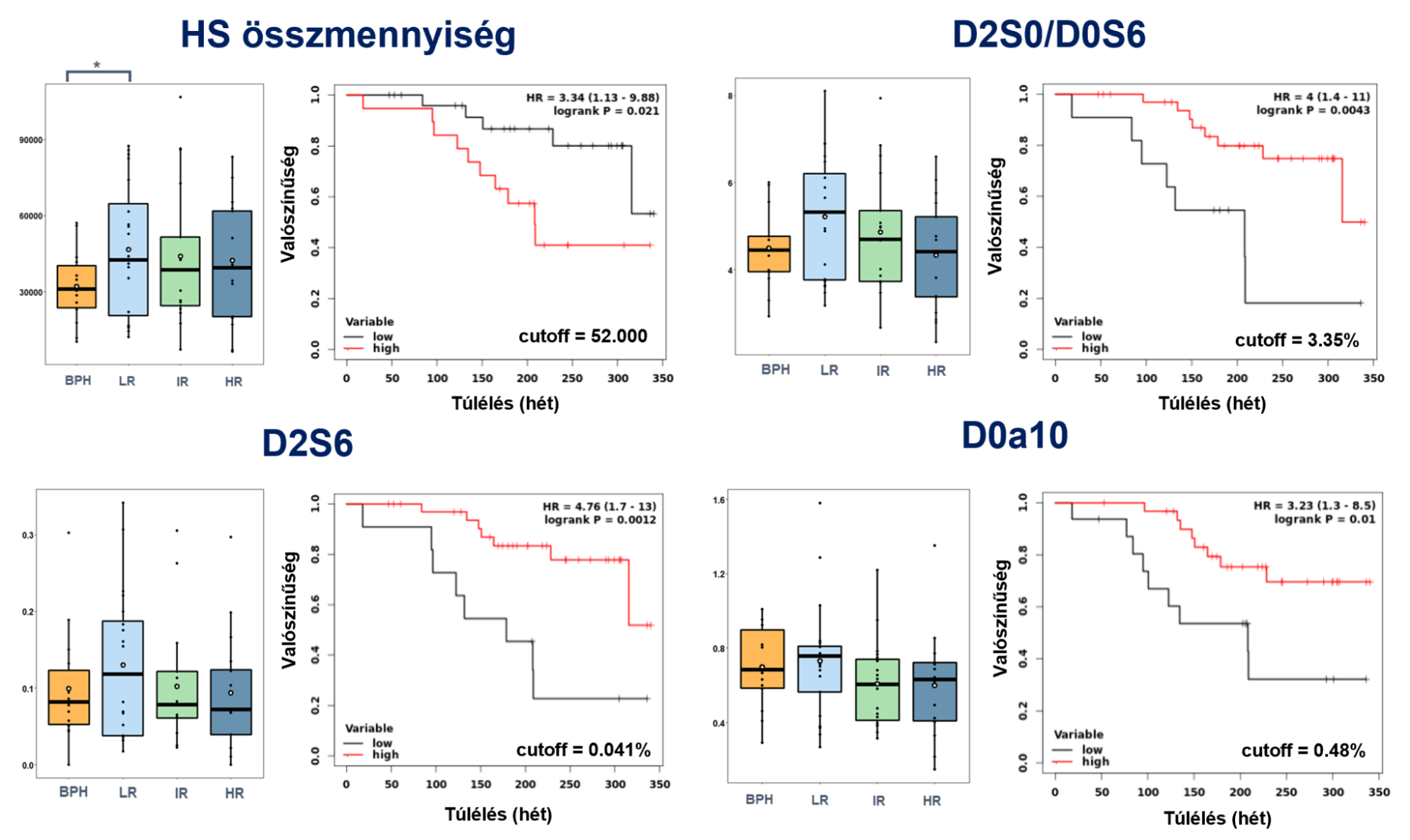
5. ábra A szignifikáns túlélésbeli különbségeket mutató GAG-motívumok mennyiségi összefüggései a jelenleg alkalmazott kockázaticsoport-besorolásokkal, és a hozzájuk tartozó Kaplan-Meier-ábrák
Független markerek azonosítása
A szignifikáns túlélésbeli különbséget mutató markerek függetlenségének meghatározására multivariancia-analízist alkalmaztam a klinikai paraméterek (T-stádium, PSA-vérszint, Gleason-pontszám) és az adott GAG-motívum figyelembevételével.
Megállapítottam, hogy a D2S0/D0S6 és D2S6 függetlenek a klinikai paraméterektől, mivel mindhárom klinikai paraméterrel vett összehasonlításban q<0,05 (Benjamini-Hochberg FDR-korrekció), így ezek jövőbeli klinikumba történő bevezetése növelhetné a túlélésre vonatkozó kockázatbecslés pontosságát.
Várható impakt, további kutatás
A CS-vizsgálatok során kimutatott összefüggések potenciális új terápiás célpontokat jelölnek ki, melyekkel hatékonyabbá tehető a prosztatarák biológiai terápiája. A HS-vizsgálatok során kimutatott független markerek új kockázati besorolási utakat nyithatnak prosztatarákos betegek terápiás döntéseinek meghozatalához. Ehhez szükséges a kimutatott eredmények validálása nagy (n>1000) esetszámú vizsgálati csoportokon. Ennek sikere esetén pedig célzott vizsgálatokat végzését tervezzük arra irányulóan, hogy a kimutatott markerek noninvazív mintavételezéssel (pl. vizelet) is kimutathatók-e, így egyszerűen implementálhatók-e a klinikai gyakorlatba.
Saját publikációk, hivatkozások, linkgyűjtemény
IF: impakt faktor
Közvetlenül kapcsolódó saját publikációk listája
[S1] Lilla Turiák, Gábor Tóth, Oliver Ozohanics, Ágnes Révész, András Ács, Károly Vékey, Joseph Zaia, László Drahos, Sensitive method for glycosaminoglycan analysis of tissue sections, Journal of Chromatography A, 2018, IF: 3,858
[S2] Lilla Turiák, Oliver Ozohanics, Gábor Tóth, András Ács, Ágnes Révész, Károly Vékey, András Telekes, László Drahos, High sensitivity proteomics of prostate cancer tissue microarrays to discriminate between healthy and cancerous tissue, Journal of Proteomics, 2018, IF: 3,509
[S3] Tóth Gábor, Vékey Károly, Drahos László, Turiák Lilla, A proteoglikánok és műszeres analitikai vizsgálatuk, Magyar Kémikusok Lapja, 2019, IF: -
[S4] Gábor Tóth, Károly Vékey, László Drahos, Viola Horváth, Lilla Turiák, Salt and solvent effects in the microscale chromatographic separation of heparan sulfate disaccharides, Journal of Chromatography A, 2020, IF: 4,759
[S5] Gábor Tóth, Károly Vékey, Simon Sugár, Ilona Kovalszky, László Drahos, Lilla Turiák, Salt gradient chromatographic separation of chondroitin sulfate disaccharides, Journal of Chromatography A, 2020, IF: 4,759
[S6] Simon Sugár, Gábor Tóth, Fanni Bugyi, Károly Vékey, Katalin Karászi, László Drahos, Lilla Turiák, Alterations in protein expression and site-specific N-glycosylation of prostate cancer tissues, Scientific Reports, 2021, IF: 4,379
[S7] Tóth Gábor, A rákkutatás jövője? – Fehérjék és cukrok vizsgálata mikrometszeteken, Élet és Tudomány, 2021, IF: -
[S8] Gábor Tóth, Domonkos Pál, Károly Vékey, László Drahos, Lilla Turiák, Stability and recovery issues concerning chondroitin sulfate disaccharide analysis, Analytical and Bioanalytical Chemistry, 2021, IF: 4,142
Közvetetten kapcsolódó saját publikációk listája
[S9] Lilla Turiák, Simon Sugár, András Ács, Gábor Tóth, Ágnes Gömöry, András Telekes, Károly Vékey, László Drahos, Site-specific N-glycosylation of HeLa cell glycoproteins, Scientific Reports, 2019, IF: 3,998
[S10] Gábor Tóth, Fanni Bugyi, Simon Sugár, Goran Mitulović, Károly Vékey, Lilla Turiák, László Drahos, Selective TiO2 Phosphopeptide Enrichment of Complex Samples in the Nanogram Range, Separations, 2020, IF: 2,777
[S11] Andrea Reszegi, Katalin Karászi, Gábor Tóth, Kristóf Rada, Lóránd Váncza, Lilla Turiák, Zsuzsa Schaff, András Kiss, László Szilák, Gábor Szabó, Gábor Petővári, Anna Sebestyén, Katalin Dezső, Eszter Regős, Péter Tátrai, Kornélia Baghy, Ilona Kovalszky, Overexpression of Human Syndecan-1 Protects against the Diethylnitrosamine-Induced Hepatocarcinogenesis in Mice, Cancers, 2021, IF: 6,860
[S12] Gábor Tóth, Domonkos Pál, Simon Sugár, Ilona Kovalszky, Katalin Dezső, Gitta Schlosser, László Drahos, Lilla Turiák, Expression of glycosaminoglycans in cirrhotic liver and hepatocellular carcinoma – A pilot study including etiology, Analytical and Bioanalytical Chemistry, 2022, IF: 4,142
Egyéb saját publikációk listája
[S13] Simon Sugár, Fanni Bugyi, Gábor Tóth, Judit Pápay, Ilona Kovalszky, Tamás Tornóczky, László Drahos, Lilla Turiák, Proteomic analysis of lung cancer types – a pilot study, Cancers, 2022, IF: 6,860
[S14] Dr. Róbert István Agócs, Dr. Domonkos Pap, Dániel András Sugár, Gábor Tóth, Lilla Turiák, Dr. Zoltán Veréb, Prof. Lajos Kemény, Prof. Tivadar Tulassay, Dr. Ádám Vannay, Prof. Attila József Szabo, Cyclooxygenase-2 Modulates Glycosaminoglycan Production in the Skin during Salt Overload, Frontiers in Physiology, 2020, IF: 4,566
[S15] Gábor Tóth, Tanja Panić-Janković, Goran Mitulović, Pillar array columns for peptide separations in nanoscale reversed-phase chromatography, Journal of Chromatography A, 2019, IF: 4,049
[S16] Ádám Pálvölgyi, Zsolt Rapi, Oliver Ozohanics, Gábor Tóth, György Keglevich, Péter Bakó, Synthesis of alkyl a- and b-D-glucopyranoside-based chiral crown ethers and their application as enantioselective phase-transfer catalysts, Research on Chemical Intermediates, 2018, IF: 2,064
[S17] Zsolt Rapi, Oliver Ozohanics, Gábor Tóth, Péter Bakó, Lajos Höfler, Tamás Nemcsok, Nándor Kánya, György Keglevich, Syntheses and complexing ability of α-d-gluco- and α-d-xylofuranoside-based lariat ethers, Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2016, IF: 1,095
Linkgyűjtemény
● MS Proteomika Kutatócsoport honlapja
● Tóth Gábor: A daganatterápiák kulcsa - fehérjék és szénhidrátok vizsgálata
● Proteoglikánok és műszeres analitikai vizsgálatuk a Magyar Kémikusok Lapjában
Hivatkozások listája
[H1] A.K. Singh, R. Kumar, A.K. Pandey, Hepatocellular Carcinoma: Causes, Mechanism of Progression and Biomarkers, Curr Chem Gen Translat Med. vol. 12 (2018). pp. 9–26.
[H2] Ahrens TD, Bang-Christensen SR, Jørgensen AM, Løppke C, Spliid CB, Sand NT, Clausen TM, Salanti A, Agerbæk MØ, The Role of Proteoglycans in Cancer Metastasis and Circulating Tumor Cell Analysis. Front. Cell Dev. Biol. (2020) 8:749.
[H3] A. Pudełko, G. Wisowski, K. Olczyk, E.M. Koźma, The dual role of the glycosaminoglycan chondroitin-6-sulfate in the development, progression, and metastasis of cancer, The FEBS Journal. vol. 286 (2019). pp. 1815–1837.
[H4] G.K. Tan, Y. Tabata, Chondroitin-6-sulfate attenuates inflammatory responses in murine macrophages via suppression of NF-κB nuclear translocation, Acta Biomaterialia. vol. 10 (2014). pp. 2684–2692.
