|
|
BMe Kutatói pályázat |
|
Oláh György Doktori Iskola
VBK, Fizikai Kémia és Anyagtudományi Tanszék
Témavezető: Dr. Gyarmati Benjámin
Mukoadhézióval az effektívebb hatóanyagleadásért
A kutatási téma néhány soros bemutatása
A nyálkahártyára tapadó (1. ábra), úgynevezett mukoadhezív hatóanyag-leadó rendszerek segítségével elnyújtott helyi és szisztematikus hatás egyaránt elérhető magas biohasznosulás és beteg-együttműködés mellett [1–3]. Annak ellenére, hogy már léteznek ilyen forgalomban lévő készítmények, minősítésük nem standardizált, illetve a tapadást meghatározó tényezők ismerete hiányos [4–6]. PhD munkám célja, hogy azonosítsam a mukoadhéziós folyamat meghatározó tényezőit és olyan polimer hidrogél-alapú nyálkahártya analógot dolgozzak ki, mely segíthet a mérés standardizálásában.
1. ábra Tesa Mucofilm® egy bukkális mukoadhezív film
A kutatóhely rövid bemutatása
A Lágy Anyagok Kutatócsoport jelentős tapasztalattal rendelkezik polimerek és gélek szintézisében és jellemzésében [7–9]. Ezen ismereteket kiválóan tudjuk hasznosítani a mukoadhézió méretskálákon átívelő mechanizmusának megértéséhez. Az adhézió folyamatának molekuláris megértéséhez egyedi kémiai karakterű polimereket szintetizálunk, melyekkel jelenleg a molekuláris szintű mukoadhéziós kölcsönhatásokat tanulmányozzuk.
A kutatás történetének, tágabb kontextusának bemutatása
Egy hatóanyag-leadó rendszer esetében a biztonságosság mellett a legfontosabb szempont, hogy az abban lévő hatóanyag felszívódjon, és a kívánt hatást váltsa ki szisztémásan vagy a lokálisan. Amennyiben szisztémás hatás elérése a cél, a leggyakoribb út az ún. per os, azaz szájon át, lenyeléssel történő bevitel. Ilyenkor jellemzően a vékonybélből vagy a gyomorból szívódik fel a hatóanyag, majd a májba jut, ahol megkezdődik az ún. first pass metabolizmus, aminek eredményeként a hatóanyag egy jelentős része elbomolhat, ami amellett, hogy csökkenti a hatóanyag hasznosulását, mellékhatások kialakulásához is vezethet [1–6].
A nyálkahártyán keresztüli (transzmukozális) hatóanyag-bevitelnél a szájon át történő hagyományos bevitellel ellentétben, a hatóanyag egyenesen a szisztémás keringésbe jut, ami nagyobb biohasznosulást eredményezhet, és csökkentheti a mellékhatások kialakulásának esélyét [1–6]. Ilyen transzmukozális hatóanyag-leadásra használt dózisforma például egy, a száj belső nyálkahártyáján megtapadó polimer film (pl.: Belbucca®) vagy tabletta (pl.: Fentora®), amely tartós fájdalomcsillapításra szolgálhat, de egy, a hüvely belső falára feltapadó fogamzásgátló formuláció (pl.: VCF®) is ilyen készítmény.
A mukoadhézió jelenségének kiaknázása azonban nem egyszerű, mivel egy nagy víztartalmú nyálkaréteggel borított lágy szöveten (a nyálkahártyán) kell tartós tapadást elérni, ami komoly kihívást jelent [1, 4-6], hiszen a nyálkahártya biológiai funkciója a síkosítás mellett éppen az, hogy a kórokozókat, szennyeződéseket, idegen anyagokat távol tartsa a szervezetünkből.
A kutatás célja, a megválaszolandó kérdések
Mukoadhezív dózisformák tudatos tervezéséhez ismerni kell a mukoadhézió folyamatát [4–6]. Célom, hogy meghatározzam a tapadás erősségét és a tapadás idejét befolyásoló tényezőket. Jelenleg a folyamat mechanizmusára a szakirodalomban csak rosszul definiált elméletek léteznek (2. ábra), amelyek ugyan némi támpontot adnak a lényeges tényezőkkel kapcsolatban, de nem szolgáltatnak információt arról, hogy különböző formulációk és különböző nyálkahártyák esetén melyik effektus milyen súllyal vesz részt az adhézió kialakításában és fenntartásában.
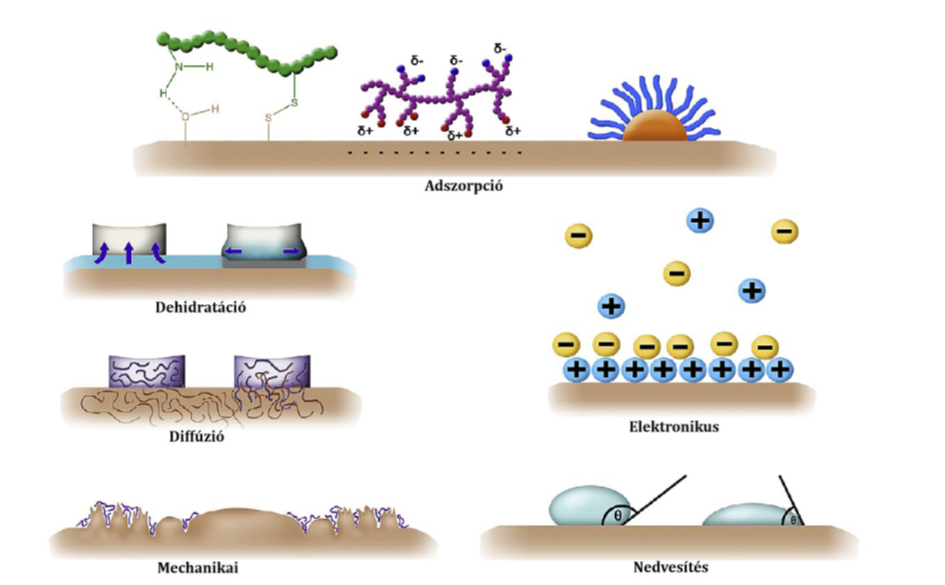
2. ábra Mukoadhéziós elméletek [12]
A folyamat jelenleg hiányos ismeretének egyik fő oka, hogy a mukoadhézió mérése jellemzően állati szöveteken, ex-vivo történik, mely minták alapvetően a biológiai diverzitás miatt is jelentősen eltérnek, majd ehhez adódnak hozzá a biológiai minták preparálása és tárolása során bekövetkező változások, amelyek jelentős véletlen hibaként jelentkezhetnek a mérések során [5, 6]. Ezen hibák csökkentéséhez szükség van egy olyan modellszubsztrátra (a tapadás méréséhez használt felületre), amely az adhéziós tulajdonságok szempontjából jól modellezi a nyálkahártyát, és kellően robosztus, jól reprodukálható méréseket eredményez [5,6,10]. Egy ilyen modellszubsztráton már képesek lehetünk az egyes meghatározó faktorok súlyait a különböző esetekben meghatározni. A makroszkopikusan tapasztalható adhézió mögött álló molekuláris, kolloidális jelenségeket és kölcsönhatásokat is célom feltérképezni a folyamatok mélyebb megértéséhez, hiszen vonzó határfelületi kölcsönhatások nélkül az adhézió kialakulása nem képzelhető el. Ehhez az adhézióhoz vezető, határfelületi vonzó kölcsönhatásokat vizsgálom [4–6].
Módszerek
A mukoadhézió hierarchikus folyamatának megértéséhez vizsgálom a molekuláris kölcsönhatásokat. Az ilyen kölcsönhatások vizsgálata jellemzően a mucin fehérjével (glikoproteinnel) szemben történik, hiszen ez a nyálkahártyán lévő nyálkaréteg fő makromolekulás komponense, illetve a nyálkaréteg alatti membránon, kötött formában is jelen van. A mucin glikoprotein (3. ábra) hasonlít egy üvegmosó kefére, mert fehérje alapláncáról cukoralegységekből felépülő oligoszacharidok lógnak le. Ezen cukoralegységek végein jellemzően egy-egy sziálsav (pKa ~ 2,7) található, mely a gyomron kívül, minden nyálkahártyán negatív töltést kölcsönöz a mucinnak. A karbonsav funkcionalitáson kívül jellemző a mucinra a tiol funkciós csoport jelenléte is, melyet az alapláncban lévő cisztein aminosavban gazdag régiók szolgáltatnak. A mucin elsődleges szerkezetén kívül rendkívül fontos, hogy ezen mucinalegységek kovalensen, diszulfid hidakon, valamint hidrofób asszociációkon keresztül egy térhálós struktúrát képesek létrehozni, mely egy (közel) alaktartó hidrogél [4-6, 11,13].
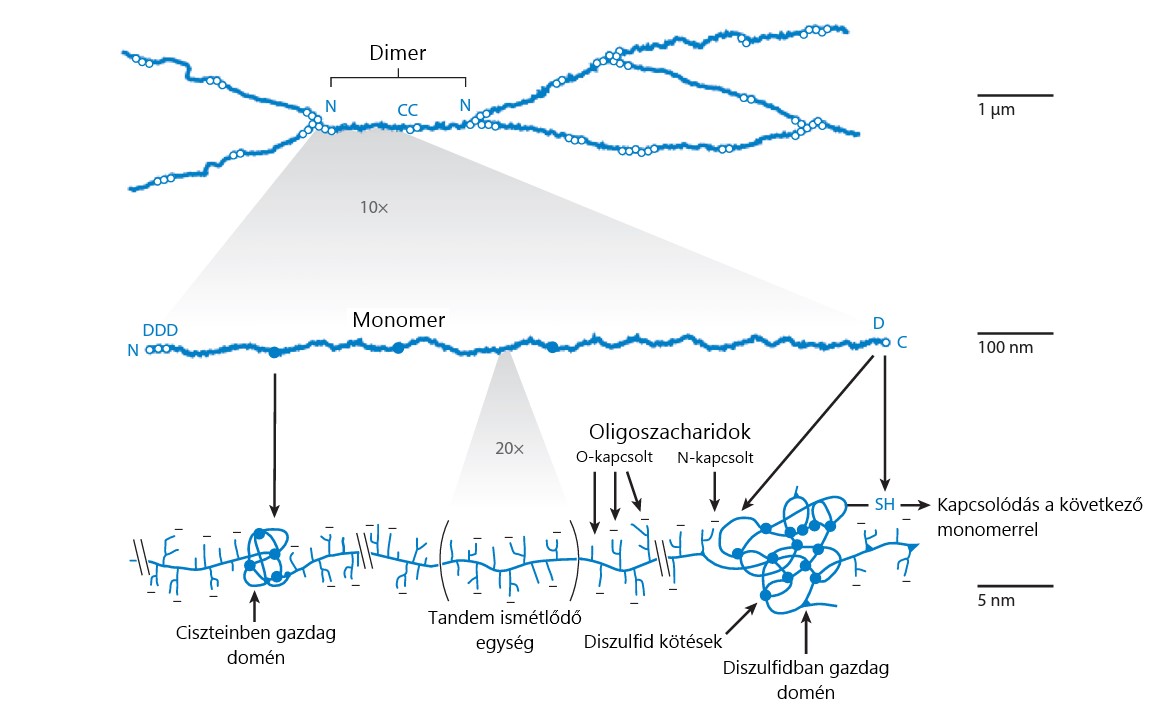
3. ábra A mucin glikoprotein szerkezete [13]
Vizsgálataimhoz kereskedelemben kapható, mukoadhezívként alkalmazott és általam szintetizált polimereket is felhasználok. A kereskedelmi polimerek közül enyhén térhálós poliakrilsavat (Carbopol®), kitozánt és hidroxipropil-metilcelluózt (HPMC) alkalmazok töltés szempontjából eltérő karakterük miatt (a felsorolás sorrendjében negatív, pozitív töltés, illetve semleges). A saját polimereim poliaszpartamidok, melyek nagyon változatos oldalcsoportokkal rendelkezhetnek aszerint, hogy a poliszukcinimid alapláncot milyen ágenssekkel és milyen arányban módosítom [SG 2,3]. Így a kapott poliaszpartamid lehet anionos, kationos vagy semleges karakterű, és rendelkezhet például tiolcsoportokkal vagy akár hidrofób karakterrel is.
A polimerek molekuláris szinten való vizsgálatát izotermikus titrálásos kalorimetriával valósítom meg, mellyel kvantifikálható a folyamatok hőszínezete és egyensúlyi állandója. Itt jelenleg a mucin analógjaként egy negatív töltésű poli(aminosavat) alkalmazok. Kolloid mérettartományban, vékony rétegben, kvarckristály mikromérleggel (QCM) (4. ábra) végzek méréseket, mellyel képes vagyok kvantitatívan vizsgálni, hogy hány mikrogramm polimer kötődik meg egységnyi tömegű mucinon. A részecskés, kolloid mérettartományú mérések, a mucin és polimer vonzó kölcsönhatásokon keresztül létrejövő részecskeképzésén alakulnak, és kiegészítik a vékony rétegben végzett mérések eredményeit. UV-Vis spektroszkópiával követem a látszólagos abszorbancia változását (turbidimetria), dinamikus fényszórás (DLS) méréssel a részecskeméret, valamint zeta-potenciál méréssel a felületi töltés változását.
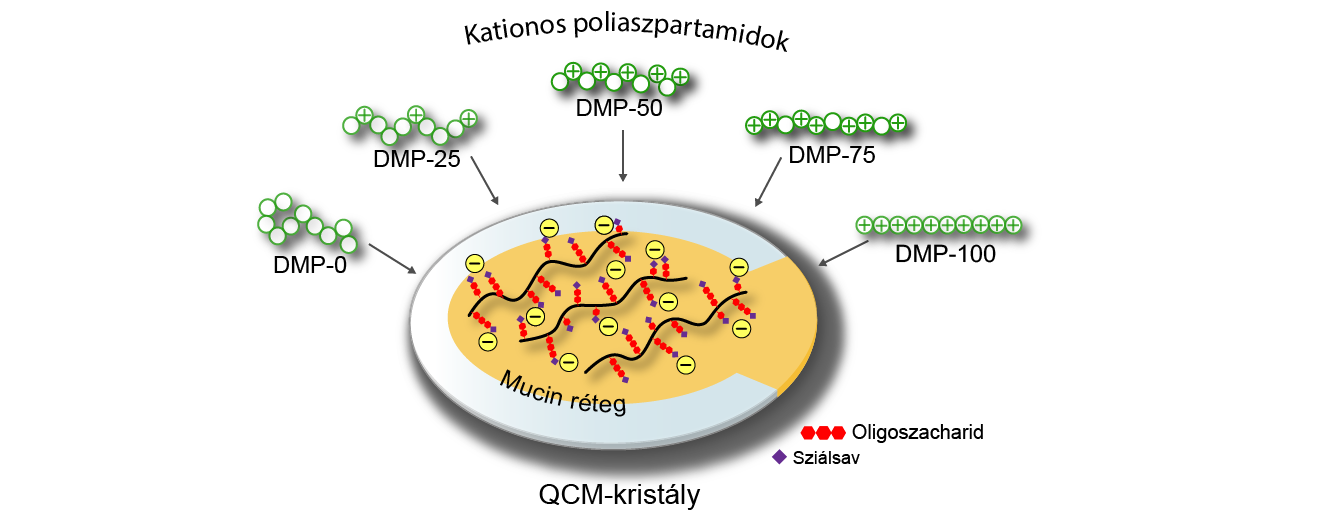
4. ábra különböző mennyiségű kationos csoportot tartalmazó polimerek megkötése QCM-kristályra felvitt vékony mucinrétegen [SG2]
A makroszkopikus adhézióvizsgálatokhoz (5. ábra) tablettákat préselek a polimereimből, majd egy mechanikai tesztelőberendezés segítségével a szubsztráttal (nyálkahártya analóggal) hozom kontaktusba, ott meghatározott ideig állandó erőn tartom, majd lassan, állandó sebességgel leválasztom a felületről. A mérés során a távolság függvényében rögzítem az erőt, amiből adhéziós munkát és erőt számítok. Ilyen típusú mérésekhez állítok elő hidrogélnyálkahártya-analógokat, melyek viszkoelaszikus tulajdonságait – amelyek az adhézió energiadisszipáló folyamataiban jelentős szerepet játszanak – jellemzem és hangolom a természetes nyálkahártyákkal hasonlatosra.
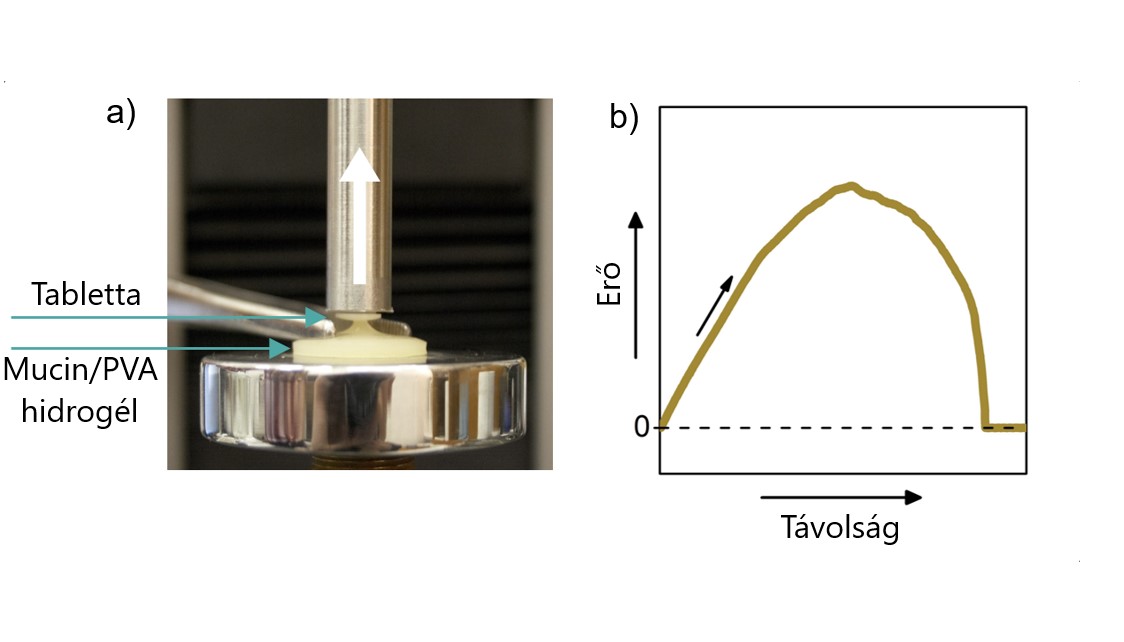
5. ábra Makroszkopikus adhézió vizsgálat az általam fejlesztett Mucin/PVA hidrogélen a) a tapadás demonstrációja (nem a teljes mérési elrendezés) b) az adhéziós vizsgálat során nyert adhéziós görbe [SG1]
Eddigi eredmények
Kvarckristály-mikromérleg (QCM) alkalmazásával nemlineáris polimerszerkezet – tulajdonság kapcsolatot tártam fel poliaszpartamidok kationos oldalcsoport-tartalma és a mucin rétegen való megkötődésük között (6. ábra). Vékony réteg mucinon közepes (50–75%) kationos oldalcsoport-tartalom mellett kötődött meg a legtöbb az általam szintetizált és vizsgált poliaszpartamidból. A polimer szerkezet ennek megfelelően tervezhető a későbbiekben, az 50%-os kationos oldalcsoport-tartalom mellett más funkcióscsoportok (például tiolcsoportok) is helyet kaphatnak a polimerláncon, melyek további vonzó kölcsönhatásokat képesek kialakítani a mucin glikoproteinnel, így növelve tovább a mukoadhézió erősségét és remélhetően a dózisforma retenciójának idejét a nyálkahártyán.

6. ábra Kationos poliaszpartamidok megkötődésének mértéke a kationos oldalcsoport-tartalom mennyiségének függvényében [SG2]
DLS-, turbidimetria- és zeta-potenciál-méréseim alapján elméletet javasoltam a polimer – mucin vonzó kölcsönhatásokon keresztül megvalósuló részecskeképződésére, a részecskék szerkezetének, valamint méretének és számának megváltozására a polimer/mucin arány változásával. Az elmélet segíthet a kolloidális szintű mukoadhéziós eredmények értelmezésében, így egyszerű és nagy áteresztőképességű módszerekből képesek leszünk alapvető információt kinyerni a polimer – mucin kölcsönhatásokra vonatkozóan. Ez gyorsítja majd az új polimerek mukoadhéziós tulajdonságainak screenelését.
A mukoadhézió makroszkopikus szintű méréséhez robosztus nyálkahártya-analógot, egy mucint tartalmazó hidrogélt hoztam létre. A mucin fehérjét fagyasztási-olvasztási ciklusokkal, kémia térhálósítás nélkül, egy csak -OH funkciós csoportokat tartalmazó poli(vinil-alkohol) térhálóba zártam, aminek köszönhetően a mucin glikoprotein kémiai karaktere nem sérült. Ezen a modellszubsztráton kiváló reprodukálhatósággal valósítottam meg ismert szilárd mukoadhezív dózisformák mérését (7. ábra). A poliakrilsav (PAA, Carbopol®) erős, a hidroxipropil-metilcellulóz mérsékelt adhéziót mutatott a mucintartalmú hidrogél modellfelszínen, hasonlóképp, mint ahogy az irodalomban ezt ex-vivo mérésekben meghatározták. A Carbopol tabletta valószínűsíthetően poli-ionos és enyhén keresztkötött karaktere miatt mutat jelentősen nagyobb adhéziót, mint a HPMC. Feltételezhetően, az ionos karakter miatt nagy ozmózisnyomás alakul ki, mely elősegíti a polimerláncok nagyobb mértékű átlépését a határfelületen.
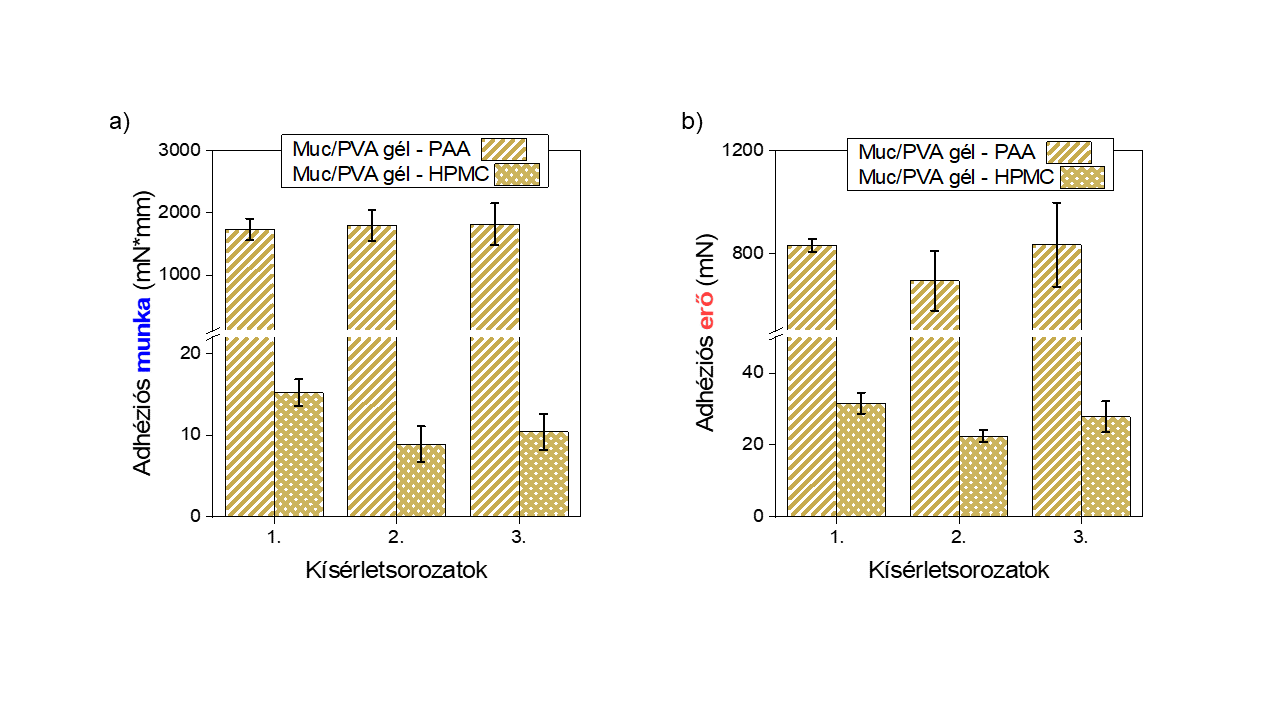
7. ábra Mucin/PVA hidrogélen, mint nyálkahártya analógon mért adhéziómérések eredményei poliakrilsav (PAA, Carbopol®) és hidroxipropil-metilcellulóz (HPMC) tablettákra a) a számított adhéziós munkák b) adhéziós erők [SG1]
Igazoltam, hogy a nyálkahártya-analógomban lévő mucinnak, elektrosztatikus kölcsönhatások kialakításán keresztül van szerepe a kialakuló adhézió erősségére (8. ábra). A mucint tartalmazó gél esetében nagyobb adhéziót mértem a kationos kitozán tablettára, mint a mucint nem tartalmazó PVA gélen. Az anionos poliakrilsav tabletta esetén fordított volt a reláció. A semleges hidroxi-metil-cellulóz (HPMC) esetében pedig nem volt szignifikáns különbség tapasztalható. Mindezen eredményekkel igazoltam az elektrosztatikus kölcsönhatások makroszkopikus szintű adhézióban való szerepét.
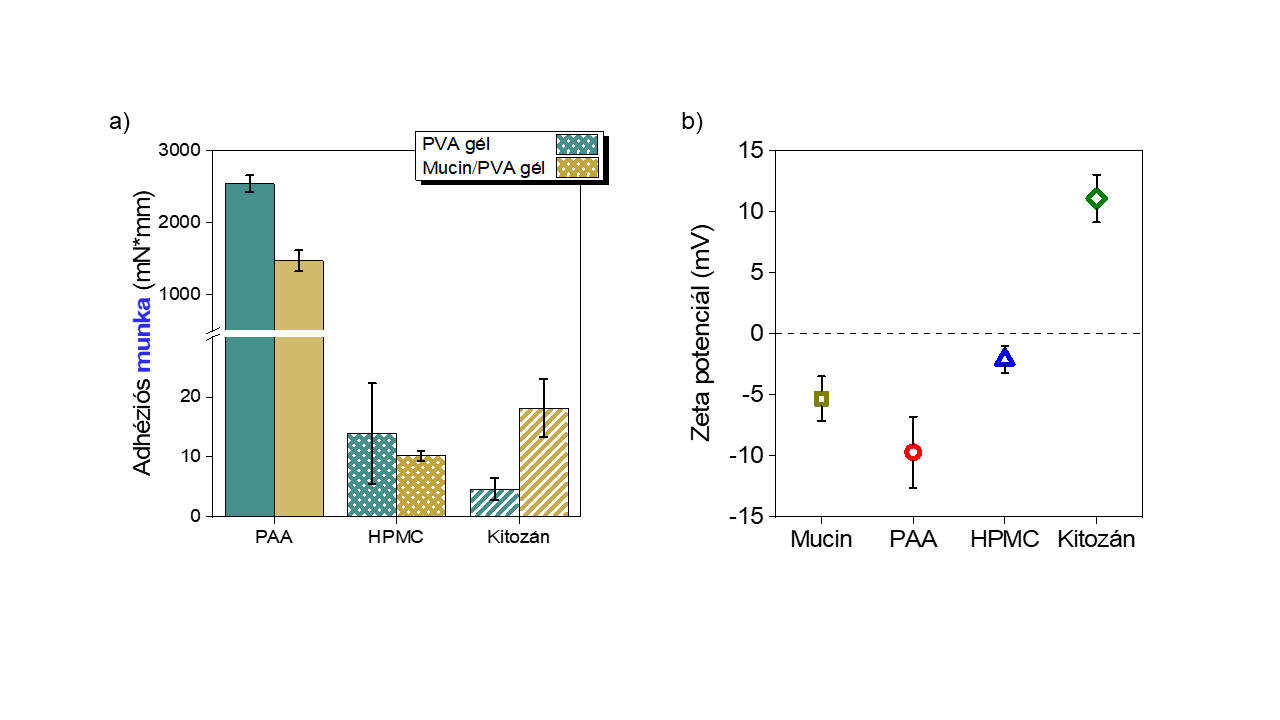
8. ábra a) Mucin/PVA és PVA hidrogélen, mint nyálkahártya-analógon mért adhéziós munkák poliakrilsav (Carbopol®), hidroxipropil-metilcellulóz (HPMC) és kitozán tablettákra b) zeta-potenciál-mérések a különböző polimerekre [SG1]
Várható impakt, további kutatás
A munka fontosságát jól mutatja, hogy doktori munkám első fő cikke a mucint tartalmazó hidrogél nyálkahártya-analóg szintéziséről egy magas impakt faktorú Q1-es folyóiratban, a Colloids and Bionterfaces B.-ben (IF = 5,999) jelent meg 2022-ben, és már rendelkezik független hivatkozással. Jelenlegi munkám, ahol különböző kationos oldalcsoport-tartalmú poliaszpartamidok megkötődését vizsgáltam vékony mucinrétegen, pedig bírálat alatt áll a International Journal of Biological Macromolecules, szintén Q1-es (IF = 8,025) folyóiratban. További munkámban még inkább az adhézió részfolyamatainak hierarchikus felépítésére fókuszálok, hogy minél jobban összekapcsolhatók legyenek a molekuláris és a szupramolekuláris szinten szerzett tapasztalatok. Ezen eredmények már középtávon alkalmazhatóak lehetnek új mukoadhezív gyógyszerformák fejlesztésében.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája. (IF: impakt faktor)
[S1] Gyarmati B, Stankovits G, Szilágyi BÁ, Galata DL, Gordon P, Szilágyi A. A robust mucin-containing poly(vinyl alcohol) hydrogel model for the in vitro characterization of mucoadhesion of solid dosage forms Colloids and Surfaces B: Biointerfaces 2022, 213: 112406 (IF 2022 = 5,999)
[S2] Stankovits G, Ábrahám Á, Kiss É, Varga Z, Mirsa A, Szilágyi A, Gyarmati B, The interaction between mucin and poly(amino acid)s with controlled cationic group content in bulk phase and in thin layers International Journal of Biological Macromolecules, 2023, bírálat alatt (IF 2022 = 8,025)
[S3] Gyarmati B, Mammadova A, Barczikai D, Stankovits G, Misra A, Alavijeh MS, et al. Side group ratio as a novel means to tune the hydrolytic degradation of thiolated and disulfide cross-linked polyaspartamides. Polymer Degradation and Stability, 2021,188: 109577 (IF 2021 = 5,030)
[S4] Gyarmati B, Mammadova A, Stankovits G, Barczikai D, Szilágyi A. Effect of Side Groups on the Hydrolytic Stability of Thiolated and Disulfide Cross-linked Polyaspartamides Periodica Polytechnica Chemical Engineering 2021, 65: 183–191 (IF 2021 = 1,571)
Linkgyűjtemény.
Hivatkozások listája.
[1] Gottnek M., Hódi K., ifj. Regdon G. Gyógyszerészet 2013, 57: 69-75
[2] Beg S, Swain S, Rizwan M, Irfanuddin M, Shobha Malini D. Bioavailability Enhancement Strategies: Basics, Formulation Approaches and Regulatory Considerations. Current Drug Delivery 2011: 8: 691–702
[3] Park K. Controlled drug delivery systems: Past forward and future back. Journal of Controlled Release 2014, 190: 3–8
[4] Bayer IS. Recent Advances in Mucoadhesive Interface Materials, Mucoadhesion Characterization, and Technologies Advanced Materials Interfaces 2022, 9: 2200211
[5] Khutoryanskiy VV. Advances in Mucoadhesion and Mucoadhesive Polymers. Macromolecular Bioscience 2011, 11: 748–64.
[6] Smart JD. The basics and underlying mechanisms of mucoadhesion. Advanced Drug Delivery Reviews 2005, 57: 1556–68.
[7] Gyarmati B, Mammadova A, Barczikai D, Stankovits G, Misra A, Alavijeh MS, et al. Side group ratio as a novel means to tune the hydrolytic degradation of thiolated and disulfide cross-linked polyaspartamides. Polymer Degradation and Stability 2021, 188: 109577
[8] Gyarmati B, Vajna B, Némethy Á, László K, Szilágyi A. Redox- and pH-responsive cysteamine-modified poly(aspartic acid) showing a reversible sol–gel transition. Macromolecular Bioscience 2013, 13(5): 633–640
[9] Gyenes T, Torma V, Gyarmati B, Zrínyi M. Synthesis and swelling properties of novel pH-sensitive poly (aspartic acid) gels. Acta Biomater. 2008, 4(3): 733–744.
[10] Cook MT, Khutoryanskiy VV. Mucoadhesion and mucosa-mimetic materials—A mini-review. International Journal of Pharmaceutics Volume 2015, 495 (2): 991–998
[11] Navarro LA, French DL and Zauscher S, Advances in mucin mimic synthesis and applications in surface science Current Opinion in Colloid & Interface Science 2018,
38: 122–134
[12] Cook SL, Bull SB, Methven L, Parker JK, Khutoryanskiy VV Food Hydrocolloids, Mucoadhesion: A food perspective 2017, 72: 281–296
[13] Carlson TL, Lock JY and Carrier RL Engineering the Mucus Barrier Annual Review of Biomedical Engineering 2018, 20: 197–220
