 |
BMe Kutatói pályázat |

|
Vegyészmérnöki és Biomérnöki Kar
Alkalmazott Biotechnológia és Élelmiszertudományi Tanszék/Fermentációs Félüzemi Labor
F-Labor
A kutatási terület néhány soros bemutatása
Az F-labor kutatási területei a mikroorganizmusok ipari (fermentációs) alkalmazására összpontosulnak, ami egyben a biotechnológia műveletek központi célja is. A fermentációk során a mikroorganizmusok (baktériumok, (élesztő)gombák, vírusok) szaporításakor keletkezik piacképes termék. E termékek előállításának vizsgálata, optimálása a kutatóhely feladata. Egy fermentáción alapuló biotechnológia kifejlesztésekor az elsődleges cél a mikrobák igényeinek felmérése és kielégítése a maximális termékelőállítás érdekében. A kutatások során tehát laboratóriumi léptékben kiválasztjuk a legjobb termelő mikrobát, majd további optimálással (1. tápanyagigények: szénforrás, nitrogénforrás, nyomelemek, vitaminok stb.; 2. környezeti paraméterek: pH, hőmérséklet, levegőztetés, fermentációs technika stb.) kifejlesztjük a fermentációs műveletet. Ezt követően a fermentáció nagyobb méretben történő kipróbálása teszi megbízhatóvá a kifejlesztett eljárást és képezi a technológiatranszfer alapját.
A kutatóhely rövid bemutatása
Az F-labor neve sokat elárul a kutatócsoportról: F-mint
 F. épület |
 Fermentáció |
 Feldolgozás, Fehérjeelőállítás |
 Félüzem |
A Fermentációs kísérleti üzemi kutatócsoport több mint 25 éve jött létre, mai infrastruktúrája is már több mint egy évtizede működik jelenlegi formájában. Az apparátust éppúgy használják ipari partnerek megrendeléseinek teljesítésére, mint oktatási és kutatási feladatokra. A kísérleti üzemi eszközök teremtették meg a lehetőséget, hogy a BME bekapcsolódhasson az első magyar biofinomító projektjébe, amely során a kutatás a tejsav fermentációs előállításának lehetőségeit vizsgálja.
A kutatás történetének, tágabb kontextusának bemutatása
Az 1980-as években stratégiai kérdés volt, hogy a biotechnológiai üzemeket fejlesszék, vagy elsorvasszák. Az MTA Biomérnöki Munkabizottságának szorgalmazására ezeket folytatták és fejlesztették, és a növekvő igénynek eleget téve alakult meg a BME Vegyészmérnöki karán a Fermentációs csoport, amely az akkori Mezőgazdasági Kémiai Technológia Tanszéken kapott helyet. A folyamatos ipari megbízások és tudományos, valamint technológiai fejlesztések révén létrejött az akkor nagyon korszerű fermentációs kísérleti üzem, és olyan projektekbe kapcsolódott be, mint a Biogal Gyógyszergyár antibiotikum-termelése vagy a Richter Gedeon B12 fermentációja, illetve a Kabai lizin (aminosav) gyár fermentációs technológiája.
Ha a biotechnológiát a széleskörűen elfogadott színkódrendszer szerint osztjuk fel, akkor az előbbi kutatások a vörös (egészségügyi) biotechnológiához kapcsolódnak. Noha a csoportnak voltak már munkái a zöld (mezőgazdasági, élelmiszeripari) biotechnológia területén is (pl. almafélék tűzelhalása elleni készítmény), az utóbbi évtizedben a fehér biotechnológiai kutatások dominálnak, elsősorban az 1,3-propándiol enzimes biokonverzióval történő előállítása, illetve a tejsav fermentációs előállítása révén. Mindkét kutatás szerepel a BME Kutató Egyetemi pályázatban a Biotechnológia-Egészség-Környezetvédelem Kiemelt Kutatási Terület Fehérbiotechnológiai Kutatásokat tömörítő projektjének témáiként.
A fehér biotechnológiai ágazat célja, hogy az erősen környezetterhelő
vegyipart „kifehérítse”, azaz biotechnológiák bevonásával környezetsemlegessé
alakítsa. (Céljaiban részben azonos a zöld kémia fogalmával, de eszközeiben
jelentősen különbözik.)
A vegyipar jelenlegi struktúrája erősen hierarchikus,
csúcsán az egyedüli energia- és nyersanyagforrás, a kőolaj áll. Ennek
finomításával nyerhetők az első alapmolekulák, amelyekből a vegyipari reakciók
építkeznek. A kémiai finomítók analógiájára vezették be a „biofinomító”
fogalmát, amely eleinte csak bizonyos megújuló nyersanyagokat (pl. keményítő)
volt képes termékké alakítani, ám ma már olyan 2. és 3. generációs üzemeket terveznek és valósítanak meg, amelyek rugalmasan tudnak igazodni a különböző
nyersanyagokhoz és piaci igényekhez, és ezáltal a hierarchikus rendszert egy
technológiai hálóvá alakítják.
A biofinomítók
a megújuló (növényi eredetű) alapanyagokból szintén alapköveket ún. „platform”
vegyületeket állítanak elő, amelyek már a klasszikus vegyipar számára is értékes
alapanyagok. Ilyen platformalkotó az 1,3-propándiol és a tejsav is. Előbbit
oldószerként, fagyállóként, és főleg műanyag-alapanyagként használják, a tejsavat
pedig élelmiszeripari (konzerválószer), kozmetikai (hidratálószer) és
gyógyászati célra (lebomló sebészfonal) is alkalmazzák. A poli-tejsavból
komposztálható műanyagot (fóliát, szálat) is elő lehet állítani, ezért az a
csomagolóipar egyik célmolekulája.
A kutatás célja, a megválaszolandó kérdések
Az 1,3-propándiol biológiai előállítása kutatásainkkal párhuzamosan megvalósult: 2006-ban indult be egy nemzetközi együttműködés eredményeként a Tate and Lyle fermentációs üzeme, ahol de novo rekombináns Escherichia coli fermentációval gyártják évi 40 000 t kapacitással az 1,3-propándiolt. A mikroorganizmusokkal végzett gyártás esetén a nyersanyag (glükóz) egy része mindig sejttömeggé (=biomasszává) alakul, és elvész a termékelőállítás számára, illetve gyakran más anyagcseretermékek (=metabolitok) is keletkeznek, ami további anyagveszteséggel és nehezebb termékkinyeréssel jár. Mindezek miatt csoportunkban (laborléptékben) kifejlesztettünk egy olyan kapcsolt koenzimes eljárást, amelyben a biodízelgyártás melléktermékeként keletkező (tehát megújuló eredetű) glicerinből 1,3-propándiol és oxidált koenzim (NAD+) keletkezik, utóbbit reverz reakcióban redukáljuk NADH2-vé, miközben egy újabb molekula glicerin használódik fel (ezúttal oxidálódik) 1,3-dihidroxiacetonná, a kozmetikai bőrbarnítószerek hatóanyagává. Így egy lépésben egy megújuló eredetű hulladékból lehet 2 iparilag hasznos terméket előállítani melléktermékek nélkül.
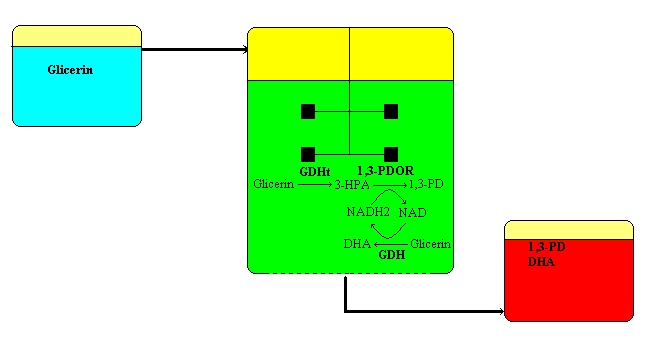
A kutatás során a kulcsenzimek előállítására
fektetünk nagy hangsúlyt, mivel azok kereskedelmi forgalomban nem kaphatók. A
természetben előforduló 1,3-propándiolt termelő mikrobák mellett saját
fejlesztésű rekombináns E. coli kialakítását is megkezdtük a hatékonyabb
enzimelőállítás céljából. A kutatás során már számos kérdést megválaszoltunk
(pl. Működhet-e egy ilyen rendszer? Igen. Újrafelhasználhatóak-e az enzimek?
Igen. stb.), de még sok kérdés nyitott. Például: Lehet-e folytonosítani az eddigi
szakaszos üzemű kísérleteket? Mi az enzimek közös kompromisszumos optimális pH
és hőmérsékleti értéke, enzimaránya? Lehet-e léptéknövelni az eljárást?
A tejsavas kutatás első mérföldkövét leraktuk, és eredményeinket Hetényi Kata a PhD disszertációjában összefoglalta. Ezek során megállapítottuk, hogy mely mezofil mikroba milyen mezőgazdasági alapanyagokon milyen tápkomponensek kiegészítésével termeli hatékonyan az L-tejsavat, illetve melyek ennek technikai paraméterei. Emellett kiválasztottunk néhány termotoleráns tejsavtermelő baktériumot is. Ezek további vizsgálata, termékinhibíciójának leküzdése, pH-szabályozásának megoldása, léptéknövelése még zajlik.
Módszerek
Az 1,3-propándiol enzimes biokonverziójához egy különleges Clostridium butyricum törzset alkalmazunk. Különlegessége, hogy míg más propándiol (és enzimeit) termelő mikrobák glicerin-dehidratáz (GDHt) enzime B12 koenzimet használ, és azzal inaktív komplexet is képez, addig a C. butyricum GDHt-ja nem szenved öninaktivációt. Ugyanakkor a mikroba szigorúan anaerob körülményeket igényel (teljes levegőkizárás), ami megnehezíti az enzimek előállítását. Mint a baktériumok többsége, ez is komplex táptalajon növekszik legjobban, ez azonban technológiailag előnytelen, mivel sok drága szerves N-forrást (pl. tripton, élesztőkivonat) tartalmaz, amelyek jelentős része érintetlenül marad, és az enzimkinyerést nehezíti, a terméket szennyezi. Ezért jelentős erőfeszítéseket teszünk a szükséges és elégséges összetevők, illetve azok mennyiségeinek meghatározására. Az enzimek intracellulárisan (=sejten belül) képződnek, ezért a sejtszaporítás után a tenyészetet ultrahanggal feltárjuk, és a sejttörmeléket centrifugálással eltávolítjuk. A kapott oldatban a sejtek valamennyi fehérjéje jelen van, innen szokás a termék-enzimet kitisztítani. Vizsgáljuk azt is, hogy milyen mértékig szükséges az enzimeket ahhoz izolálni a fehérje mátrixból, hogy költséghatékonyan lehessen működő enzimekhez jutni. A kinyert enzimek meglehetősen érzékenyek – különösen a levegő oxigéntartalmára – így stabilizálásuk az alkalmazhatóság feltétele. Jó eredményeket értünk el az enzimek kovalens kötéssel történt rögzítésével. Ilyenkor a kitinből (halüzemi hulladék) előállítható kitozán molekulákból polimer gyöngyöt készítünk glutáraldehiddel, és ehhez kötjük az enzimeket, amelyek méréseink szerint nagyságrendekkel stabilabbakká váltak.
A kutatás fontos része az enzimek aktivitásának meghatározása, ami már az oldott enzimek esetében is nehéz (a komplex háttér miatt), ám a rögzített enzimek aktivitásmérésének módszerfejlesztése még csak napjainkban kezdődött.
A kutatás kezdetétől az enzimek forrása a már említett C. butyricum, ám a természetes enzimforrás korlátozott lehetőségeket rejt magában (egy maximális enzimkihozatalnál több enzimet nem lehet kinyerni, melléktermék-képzési problémák, anaerob igény stb.), ezért megkezdtük az enzimek klónozását rekombináns baktériumba, amelynek sikere új lendületet fog adni az enzimes rendszer vizsgálatainak.
A tejsav-előállítás esetén az alkalmazott módszereket már több helyütt összefoglaltuk, ezért itt csak vázlatosan mutatjuk be: 1) kiválasztottunk egy Lactobacillus törzset, egy laboratóriumi tápközegen léptéknöveltük, 2) valós nyersanyagon reprodukáltuk a laboratóriumi tápközeg eredményeit (előbb búzaliszt, majd cukorcirok alapon, kiegészítő tápkomponensek meghatározása statisztikai kísérlettervezéssel), 3) megoldottuk a pH-szabályozási kérdéseket, 4) kinetikai modellt állítottunk föl, és használtunk a kombinált (búzaliszt keményítő) hidrolízis és fermentáció beoltási idejének meghatározására.
Mivel minden nyersanyag mellett úgy találtuk, hogy minimális élesztőkivonat-tartalom szükséges, ezért felmerült – a biofinomító-koncepciónak megfelelően – az in house (=helyben) élesztő-előállítás valamilyen hulladékon (pl. cirok bagasz). Annak eldöntésére, hogy cirok leven, bagasz hemicellulóz (=pentóz) vagy cellulóz (=hexóz) frakcióból érdemes-e élesztőt előállítani, technológia szimulációt végeztünk a kísérleti eredmények és gazdasági megfontolások alapján (=flowsheeting), amely azt mutatta, hogy a rendelkezésre álló cirokleven lehet a leghatékonyabban élesztőt előállítani a tejsav-fermentációhoz.
Eddigi eredmények
Az „1,3-propándiol enzimatikus előállítása” téma kidolgozása során több sikeres szakaszos üzemű biokonverziót hajtottunk végre ultraszűrő mögé zárt enzimes membránreaktorban. A reakcióelegy teljes lefejtését követő friss glicerinbetáplálásokkal pedig igazoltuk, hogy az oldott enzimek is több ciklusban felhasználhatók. Mivel az enzimoldatokat nem tisztítottuk ki, a dihidroxiaceton (DHA) foszforilálódott, és részben a glikolízis enzimei által melléktermékekké (vajsav, tejsav, ecetsav) alakult.
Várható impakt, további kutatás
Mindkét témából (1,3-propándiol és tejsav) született szabadalmi beadvány (P 05 00961 és P 09 00193) és egy-egy summa cum laude PhD dolgozat, összesen 5,84-es impakt faktorú nemzetközi publikációkkal. A kutatócsoport készen áll a technológia transzferre mindkét témakörben a potenciális befektetők számára, noha mindkét eljáráson van további fejlesztési lehetőség. A tejsav esetében az irodalom számos fermentációs technikát mutat be, amelyekkel kis léptékben nagy hatékonysággal lehet tejsavat előállítani, ám ezek mégsem kerültek be az ipari gyakorlatba. Ennek okát a kísérleti üzemünkben meg tudjuk vizsgálni. A PD esetében az enzimek stabilizálása és szimultán alkalmazása terén már vannak eredményeik, de további optimálással e téren is a hatékonyság további növelése és a gazdasági versenyképesség fokozása érhető el.
Saját publikációk, hivatkozások, linkgyűjtemény
Kapcsolódó saját publikációk listája:
(5 kiemelt publikáció az elmúlt 5 évből)
Hetényi, K.; Németh, Á.; Sevella, B., Investigation and modeling of lactic
acid fermentation on wheat starch via SSF, CHF and SHF technology, Periodica
Polytechnica Chemical Engineering 2011, 55(1), 11–16. (online)
Hetényi, K.; Németh, Á.; Sevella, B., Role of pH-regulation in lactic acid
fermentation: second steps in a process improvement, Chemical Engineering and
Processing: Process Intensification 2011, 50, 293–-299. (online)
Hetényi, K., Németh, Á., Sevella, B., Use of sweet sorghum juice for
lactic acid fermentation: preliminary steps in a process optimization, Journal
of Chemical Technology and Biotechnology 2010, 85, 872–877. (online)
Balássy, A., Németh, Á., Sevella, B., Immobilized enzymes availability for
glycerol -1,3-propanediol bioconversion, Hungarian Journal of Industrial
Chemistry 2009, 37, 83–88.(online)
Németh, Á., Sevella, B., Development of a New Bioprocess for Production of 1,3-propanediol I.: Modeling of Glycerol Bioconversion to 1,3-propanediol with Klebsiella pneumoniae Enzymes, Applied Biochemistry and Biotechnology 2008, 144, (1), 47–58. (online)
(5 korábbi publikáció)
Balássy, A., Németh, Á., Sevella, B., In New Enzymatical Process for
Anaerobic Utilization of Glycerol, ChemPor 2008 10th International Chemical and
Biological Conference, Braga, Portugália, 2008. szeptember 4–6.
Hetényi, K., Németh, Á., Sevella, B., Researches on renewable resources at BUTE ABFS F-Labor, Fifth Croatian Professional and Scientific Conference on Biotechnology with International Participation, Stubicke Toplice, 2007
Németh, Á., Sevella, B., Kutatások a biodízel melléktermékének hasznosítására, Magyar Kémiai Folyóirat 2007, 113, (2), 58–61. (online)
Németh, Á., Sevella, B., Forschungen für enzymatische Herstellungen der
industriellen wertvollen Glyzerin-Derivate, 17. Frühlingsakademie von Institute
für Ingenieurweiterbildung der Technische und Wirtschaftwissenschaftliche
Universitaet Budapest, Balatonfüred, 2005. május 6.
Németh, Á., Kupcsulik, B., Sevella, B., 1,3-Propanediol oxidoreductase
production with Klebsiella pneumoniae DSM2026, World Journal of
Microbiology and Biotechnology 2003, 19, (7), 659–663. (online)
Linkgyűjtemény
MTA Biomérnöki Munkabizottsága
E-Vegyérték elektronikus jegyzetek
Résztvevők bemutatása:
|
|
 |
 |
 |
|
Dr Nyeste László |
Dr
Sevella Béla egyetemi tanár |
Dr
Pécs Miklós egyetemi docens |
Dr
Németh Áron egyetemi adjunktus |
 |
 |
||
| Farkas
Ferenc technikus |
Vargyas Tamásné tisztasági referens |

